Слайд 2
Записати рівняння реакцій, вказати їх типи
SO3 + H2O?
Fe + HCl ?
N2O5 +

H2O?
CaO + HCl?
FeO + H2SO4?
Zn + H2SO4?
BaO + H2O?
KOH + H2SO4?
Fe(OH)3?
Fe + CuSO4?
Слайд 3Запишемо рівняння реакції
Fe +CuSO4 = FeSO4 + Сu

Слайд 4Fe 0+Cu+2 SO4 = Fe +2 SO4 + Сu0
Fe0 - 2e =

Fe+2 Cu+2 + 2e = Cu0
Відновник Окисник
Окиснення Відновлення
Слайд 5Основні поняття
Окиснення — це процес віддачі електрона.
Відновлення — процес прийому електрона.

Атом, що віддає електрони, називається відновником.
Атом, що приймає електрони, називається окисником.
Слайд 6Завдання: допишіть число електронів, яке було „віддане“, або „прийняте“ атомами у схемах
О
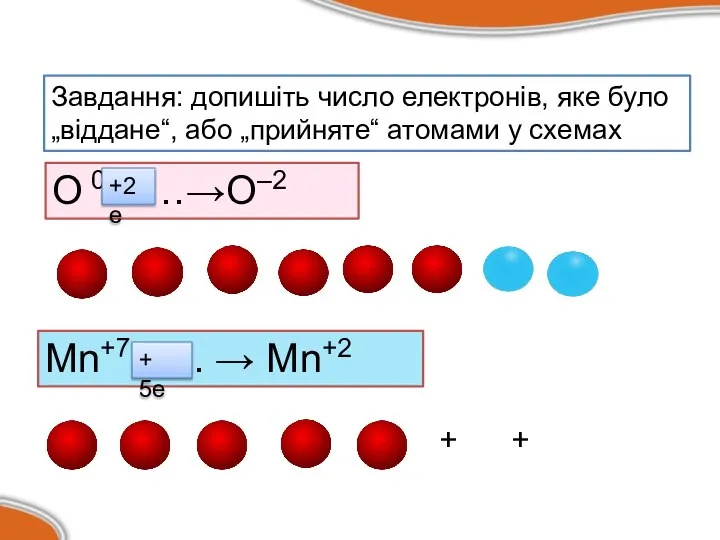
0……→О–2
Mn+7 ….. → Mn+2
+2е
+ 5e





 Аэрированный сшитый полимерный раствор (АСПР)
Аэрированный сшитый полимерный раствор (АСПР) Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Химическая связь (8 класс)
Презентация на тему Химическая связь (8 класс)  Разнообразие веществ. 3 класс
Разнообразие веществ. 3 класс Углерод
Углерод Свойства аминов
Свойства аминов Электрохимия. Экзаменационные вопросы
Электрохимия. Экзаменационные вопросы Термохимия. Термодинамические параметры
Термохимия. Термодинамические параметры Презентация на тему Полимеры и их получение
Презентация на тему Полимеры и их получение  Альдегиды, строение и свойства
Альдегиды, строение и свойства Обратимые и необратимые химические реакции. Химическое равновесие
Обратимые и необратимые химические реакции. Химическое равновесие Неорганические вещества клетки
Неорганические вещества клетки Энергетические уровни
Энергетические уровни Обобщение свойств углеводородов
Обобщение свойств углеводородов Урок №10 12 класс
Урок №10 12 класс Презентация на тему Подготовка к ГИА по химии
Презентация на тему Подготовка к ГИА по химии  Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Фуллерены (шары Бакминстера)
Фуллерены (шары Бакминстера) Селективная экстракция отдельных групп БАВ сверхкритическими флюидами
Селективная экстракция отдельных групп БАВ сверхкритическими флюидами Нефть и способы ее переработки. Октановое число - что это?
Нефть и способы ее переработки. Октановое число - что это? Сера - химический элемент и простое вещество
Сера - химический элемент и простое вещество ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Структура и функции нуклеиновых кислот
Структура и функции нуклеиновых кислот Сухая вода помогла измерить поляризацию ковалентных связей
Сухая вода помогла измерить поляризацию ковалентных связей Презентация на тему Всё об алюминии
Презентация на тему Всё об алюминии  Смог як хімічне явище
Смог як хімічне явище Реакции ионного обмена
Реакции ионного обмена Презентация на тему Лекарства 10 класс
Презентация на тему Лекарства 10 класс