Содержание
- 2. Al 13 Алюминий (лат. Aluminium) 3 8 2 26,9815 3s2 3p1
- 3. Al 13 Алюминий (лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Был впервые получен датским физиком
- 4. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Порядковый номер. Химический
- 5. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Атомная масса элемента
- 6. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Электронная конфигурация элемента
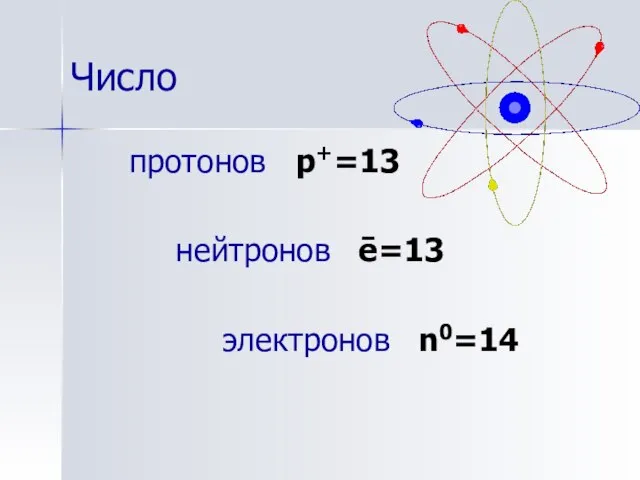
- 7. Число протонов p+=13 нейтронов ē=13 электронов n0=14
- 8. Изотопы алюминия В природе представлен лишь один стабильный изотоп 27Al. Искусственно получен ряд радиоактивных изотопов алюминия,
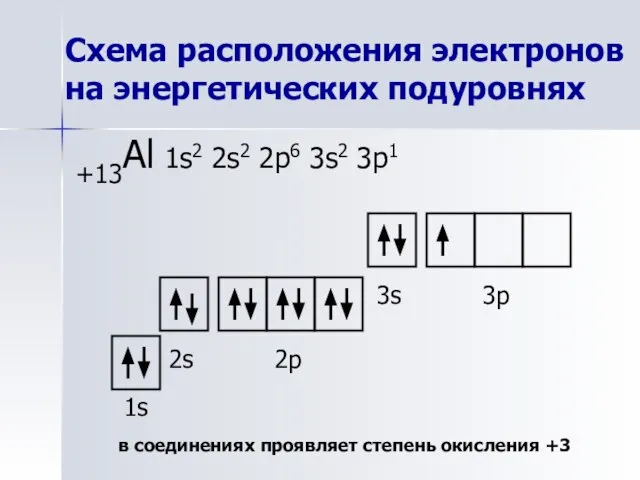
- 9. Схема расположения электронов на энергетических подуровнях +13Al 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s
- 10. Главные квантовые числа Главное квантовое число n=3 Орбитальное квантовое число l=1 Магнитное квантовое число ml=-1 Спиновое
- 11. Al – типичный металл Схема образования вещества Al 0- 3ē ↔ Al+3 Тип химической связи -металлическая
- 12. Физические свойства вещества Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает
- 13. Химические свойства вещества Al активный металл восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду
- 14. Алюминий реагирует: 1. 2Al+3O2 = 2Al2O3 + O – покрывается пленкой оксида, но в мелкораздроблен-ном виде
- 15. Получение вещества Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6), электролизом расплава AlCl3 (расходуется около
- 16. Применение Al
- 17. Ряд факторов применения алюминия: Алюминий – самый распространенный металл земной коры. Его ресурсы практически неисчерпаемы. Обладает
- 18. Оксид алюминия Al2О3: Очень твердый (корунд, рубин) порошок белого цвета, тугоплавкий - 20500С. Не растворяется в
- 19. Белый нерастворимый в воде порошок. Проявляет амфотерные свойства, взаимодействует: а) с кислотами Al (OH)3 + 3HCl
- 20. Влияние соединений алюминия на загрязнение окружающей среды. Почти все загрязняющие вещества, которые первоначально попали в атмосферу,
- 22. Скачать презентацию

















 Неметаллы в природе и жизни человека
Неметаллы в природе и жизни человека Моющие и чистящие средства
Моющие и чистящие средства Реакции, подтверждающие взаимосвязь различных
Реакции, подтверждающие взаимосвязь различных Природный газ. Алканы
Природный газ. Алканы Презентация на тему Витамин Е
Презентация на тему Витамин Е  Аммиак. Свойства (9 класс)
Аммиак. Свойства (9 класс) Явление хемилюменисценции
Явление хемилюменисценции Атом. Изотопы
Атом. Изотопы Сокровища соляных дворцов
Сокровища соляных дворцов Классы неорганических соединений
Классы неорганических соединений Углеводороды
Углеводороды Кристаллы. Формирование кристаллов
Кристаллы. Формирование кристаллов Получение азокрасителя в лабораторных условиях
Получение азокрасителя в лабораторных условиях Які існують способи розділення сумішей?
Які існують способи розділення сумішей? Таблица Д.И. Менделеева
Таблица Д.И. Менделеева Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна
Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна Щелочноземельные металлы
Щелочноземельные металлы Понятие Эффективность. Принцип Ле-Шателье
Понятие Эффективность. Принцип Ле-Шателье Химия и география. Викторина
Химия и география. Викторина Металлы и их соединения
Металлы и их соединения Лекция_классы_неогранических_соединений
Лекция_классы_неогранических_соединений Производство метанола
Производство метанола Основные классы неорганических соединений
Основные классы неорганических соединений Обмен углеводов
Обмен углеводов Номенклатура и изомерия аренов
Номенклатура и изомерия аренов Марганец. Химия элементов. Кислородосодержащие соединения
Марганец. Химия элементов. Кислородосодержащие соединения Презентация на тему Вопросы от …
Презентация на тему Вопросы от …