Содержание
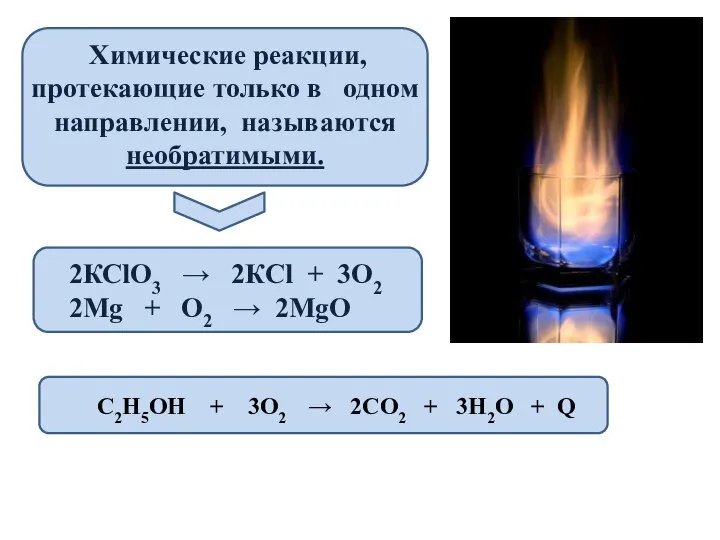
- 2. Химические реакции, протекающие только в одном направлении, называются необратимыми. 2КСlО3 → 2КСl + 3О2 2Mg +
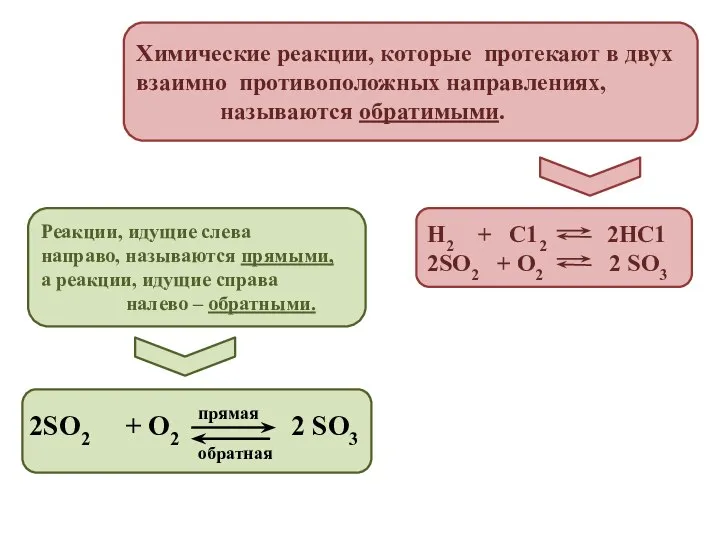
- 3. Химические реакции, которые протекают в двух взаимно противоположных направлениях, называются обратимыми. Н2 + С12 2НС1 2SO2
- 4. Если скорости прямой и обратной реакций будут равны, то такое состояние смеси реагирующих веществ называют химическим
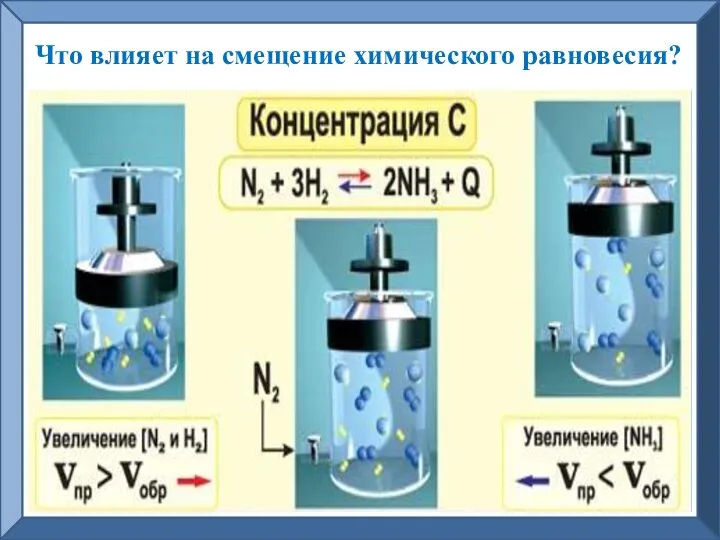
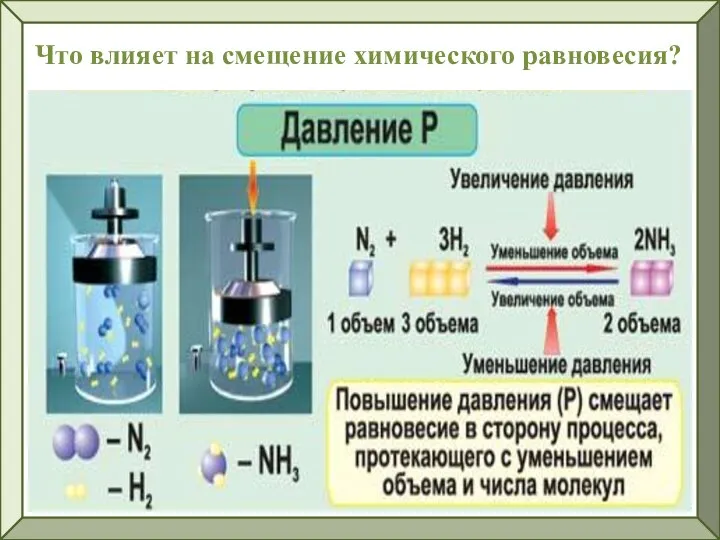
- 5. Что влияет на смещение химического равновесия?
- 6. Что влияет на смещение химического равновесия?
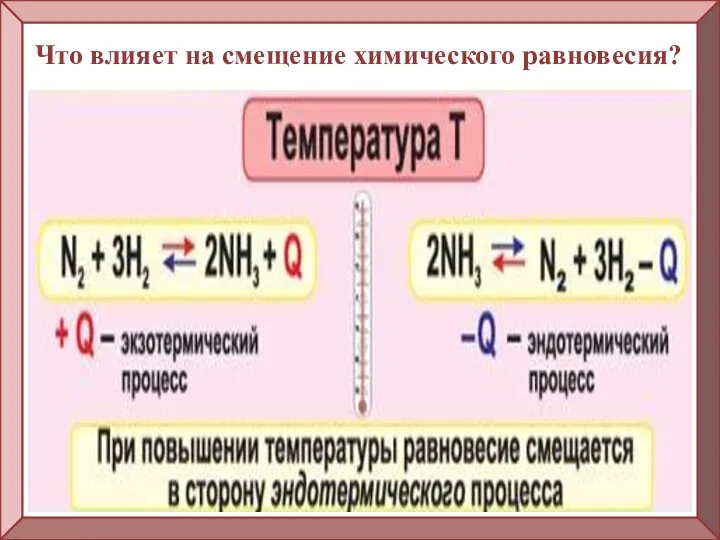
- 7. Что влияет на смещение химического равновесия?
- 9. Скачать презентацию

 Подготовка к ЕГЭ по химии
Подготовка к ЕГЭ по химии Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) Алкены. Строение. Изомерия. Химические свойства. Получение
Алкены. Строение. Изомерия. Химические свойства. Получение Физическая химия поверхностных явлений
Физическая химия поверхностных явлений Классификация и номенклатура органических соединений. Гибридизация атома С, химические связи
Классификация и номенклатура органических соединений. Гибридизация атома С, химические связи Homecredit Bank. Показатели и зоны роста
Homecredit Bank. Показатели и зоны роста Примеры реакций в жизни и в быту. Реакции по направлению процесса
Примеры реакций в жизни и в быту. Реакции по направлению процесса Презентация на тему Химия вокруг нас
Презентация на тему Химия вокруг нас  Ароматические углеводороды. Взаимное влияние радикалов в молекуле толуола
Ароматические углеводороды. Взаимное влияние радикалов в молекуле толуола Реакционная способность органических соединений
Реакционная способность органических соединений Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич
Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич Строение вещества
Строение вещества Теоретические основы органической химии. Лекция 25
Теоретические основы органической химии. Лекция 25 Тематическая викторина Химические элементы, металлы и неметаллы
Тематическая викторина Химические элементы, металлы и неметаллы Презентация на тему Характеристика элементов VII группы главной подгруппы. Хлор
Презентация на тему Характеристика элементов VII группы главной подгруппы. Хлор  Различные типы неорганических полимеров
Различные типы неорганических полимеров Физико-химические процессы в гидросфере
Физико-химические процессы в гидросфере Классификация углеводородов
Классификация углеводородов Энергетика химических реакций
Энергетика химических реакций Тепловой эффект
Тепловой эффект Презентация на тему Атомы и молекулы
Презентация на тему Атомы и молекулы  Технология производства и свойства химических волокон и тканей из них
Технология производства и свойства химических волокон и тканей из них Вещество. Простые и сложные вещества
Вещество. Простые и сложные вещества Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Скорость химической реакции
Скорость химической реакции Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Алкалоидтар. Алкалоидтарға жалпы сипаттама, жіктелуінің негізгі принциптері
Алкалоидтар. Алкалоидтарға жалпы сипаттама, жіктелуінің негізгі принциптері