Содержание
- 2. Классификация органических соединений Классификация по строению углеродной цепи
- 3. Ациклические (алифатические) – вещества с незамкнутой (открытой) цепью: предельные (насыщенные) – содержат только простые углерод-углеродные связи:
- 4. Карбоциклические: ароматические - содержат один или несколько шестичленных ароматических циклов алициклические к которым относят все остальные
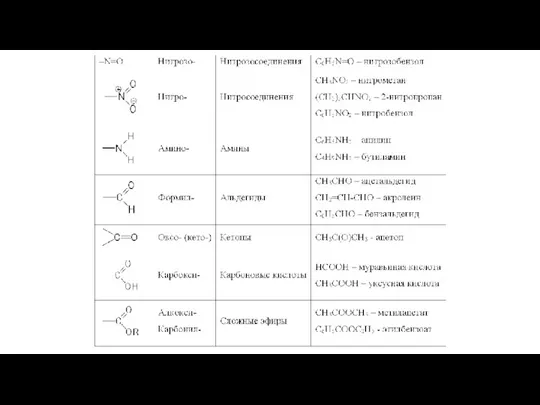
- 5. Классификация по природе функциональной группы Функциональная группа – это атом или группа атомов, наличие которых в
- 7. Соединения определенного класса объединяются в гомологические ряды в которых каждый последующий представитель отличается от предыдущего на
- 8. Номенклатура органических соединений Тривиальная номенклатура – это исторически сложившиеся названия, которые никак не отражают структуру соединения.
- 9. Рациональная номенклатура учитывает строение вещества. За основу названия берут название наиболее простого члена гомологического ряда, а
- 10. Химическая связь Параметры ковалентной связи ковалентная: неполярная С–С в H3C–CH3 полярная ионная: соли RCOO–Na+, RO–K+, R4N+Cl–
- 11. Взаимное влияние атомов в молекулах органических соединений Отрицательный (–I) заместитель оттягивает электроны на себя (акцепторный заместитель),
- 12. Направление мезомерного эффекта определяется по знаку дробного заряда, проявляющегося на заместителе, ответственном за данный эффект: -М:
- 13. При одновременном проявлении индуктивного и мезомерного эффектов, последний (М) по абсолютной величине, как правило, больше и
- 14. Классификация органических реакций Разрыв ковалентной связи: Гомолитический – каждый атом получает по одному электрону из общей
- 15. Гетеролитический (ионный) – общая электронная пара остается у одного атома: В результате образуются разноименно заряженные ионы.
- 16. Классификация по типу реакции: Присоединения (A) включает разрыв связей в молекулах и присоединение по месту разрыва
- 17. Замещения (S) один или несколько атомов или групп атомов в молекуле замещаются на один или несколько
- 18. Разложения – в результате реакции из молекулы сложного органического вещества образуется несколько менее сложных или простых
- 19. Реакции окисления и восстановления связываются с изменением степени окисления углерода, являющегося реакционным центром молекулы. Вещество окисляется,
- 20. Изомерия – явление существования соединений одинаковых по качественному и количественному составу, но различающихся порядком связывания атомов
- 21. Структурная изомерия Изомеры различаются последовательностью связывания атомов в молекуле. Изомерия цепи обусловлена разным порядком связывания атомов
- 22. Пространственная изомерия Стереоизомеры имеют одинаковый порядок соединения атомов, но различное их расположение в пространстве. Конфигурация –
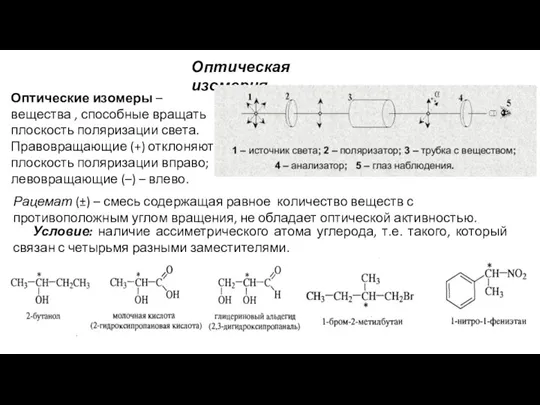
- 23. Оптическая изомерия Условие: наличие ассиметрического атома углерода, т.е. такого, который связан с четырьмя разными заместителями. Оптические
- 24. проекционные формулы Фишера Ассиметрический атом углерода изображают пересечением вертикальной и горизонтальной линии и не обозначают символом
- 25. Энантиомеры – стереоизомеры, являющиеся зеркальными отображениями друг друга и не могут быть совмещены. Диастереомеры — стереоизомеры,
- 26. Мезо-форма - оптически неактивная модификация стереоизомера. Мезо-формы имеются у всех оптически активных веществ с несколькими одинаковыми
- 27. Номенклатура оптических изомеров D,L-номенклатура Для углеводов: Для α-оксикислот и α –аминокислот: L-оксикислоты (Х = ОН) D-оксикислоты
- 28. Преобразование проекционных формул Фишера Конфигурация сохраняется при повороте формулы Фишера на 180º в плоскости чертежа, а
- 29. Конфигурация сохраняется, если делать четное число перестановок R,S-номенклатура основана на определении старшинства заместителей Атом с большим
- 30. Атом второго (или последующего) слоя, связанный двойной связью учитывается дважды. Если старшинство заместителей не удаётся определить
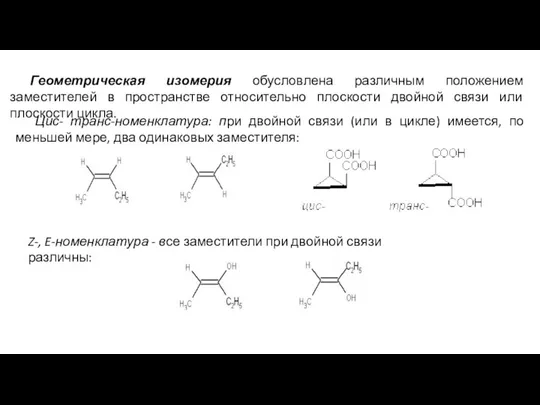
- 31. Геометрическая изомерия обусловлена различным положением заместителей в пространстве относительно плоскости двойной связи или плоскости цикла. Цис-
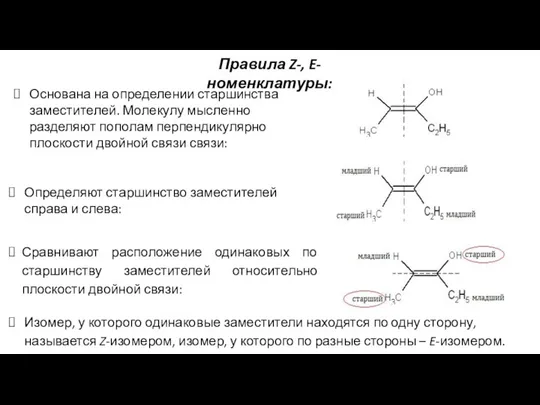
- 32. Основана на определении старшинства заместителей. Молекулу мысленно разделяют пополам перпендикулярно плоскости двойной связи связи: Определяют старшинство
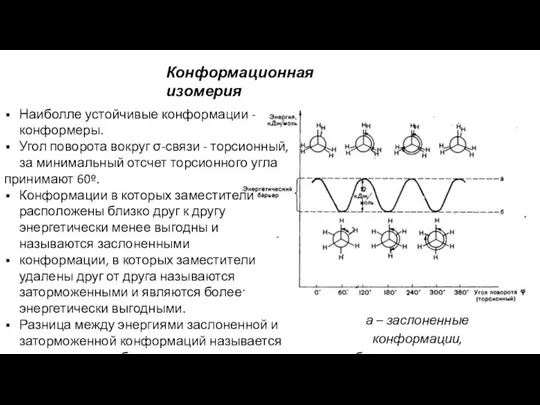
- 33. Наиболле устойчивые конформации - конформеры. Угол поворота вокруг σ-связи - торсионный, за минимальный отсчет торсионного угла
- 34. Торсионное напряжение обусловлено отталкиванием противостоящих связей. В заслоненной конформации противостоящие связи максимально сближены, поэтому взаимодействие между
- 36. Скачать презентацию




























 Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Презентация на тему Алкины. Ацетилен
Презентация на тему Алкины. Ацетилен 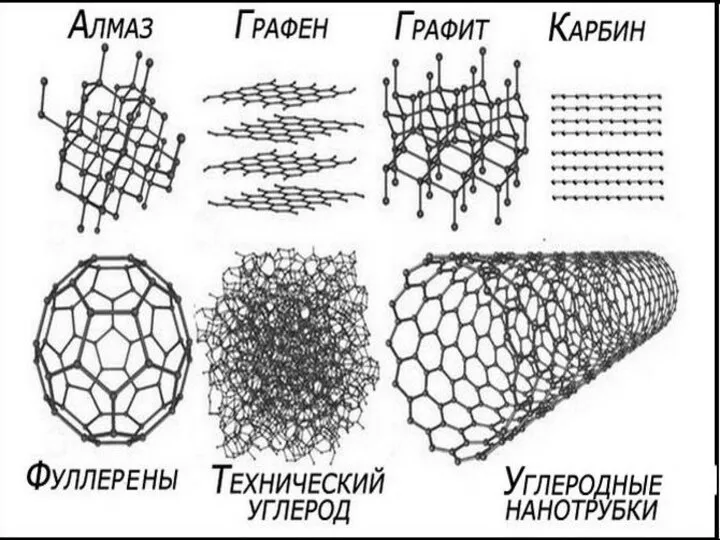 Углеродные нанотрубки
Углеродные нанотрубки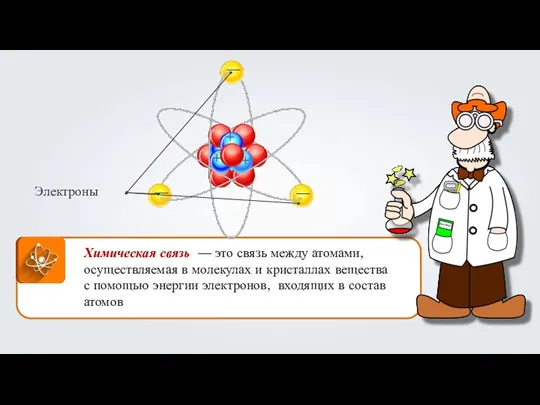 Ковалентная неполярная химическая связь
Ковалентная неполярная химическая связь Биосинтез кортикостероидов из ацетил КоА и ХС
Биосинтез кортикостероидов из ацетил КоА и ХС Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации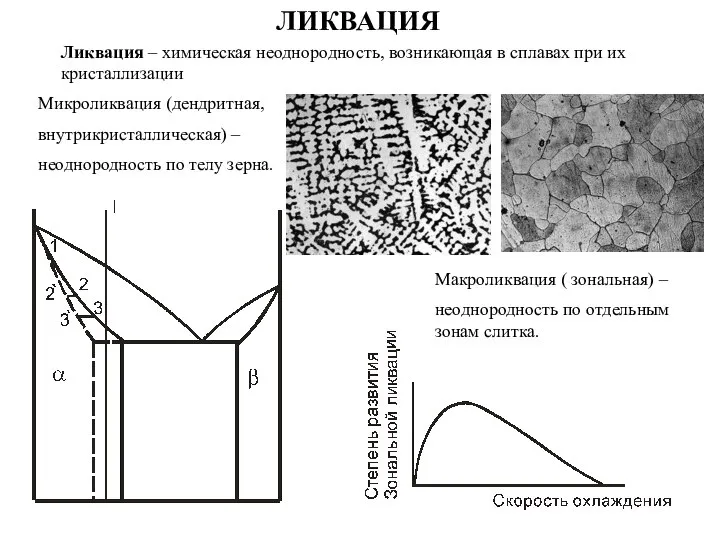 Ликвация – химическая неоднородность
Ликвация – химическая неоднородность Тестирование по химии
Тестирование по химии Природные источники углеводородов
Природные источники углеводородов Кислородсодержащие соединения азота. Оксиды азота
Кислородсодержащие соединения азота. Оксиды азота Проверочный тест. Номенклатура алканов
Проверочный тест. Номенклатура алканов Строение вещества
Строение вещества Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Синтез органічних сполук різних класів на основі вуглеводневої сировини
Синтез органічних сполук різних класів на основі вуглеводневої сировини Полімери. Пінополістирол
Полімери. Пінополістирол Роль катализа в жизнедеятельности организма. Ферментативный катализ. Классификация ферментов
Роль катализа в жизнедеятельности организма. Ферментативный катализ. Классификация ферментов Презентация на тему Синтетические моющие средства
Презентация на тему Синтетические моющие средства  Получение аминов
Получение аминов Железо и его соединения
Железо и его соединения Типичные окислители. 9 класс
Типичные окислители. 9 класс Ароматические и ненасыщенные альдегиды и кетоны
Ароматические и ненасыщенные альдегиды и кетоны Оксиды
Оксиды Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач
Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач Коррозия металлов и борьба с ней. Лабораторная работа
Коррозия металлов и борьба с ней. Лабораторная работа Химические уравнения
Химические уравнения Презентация на тему Закон постоянства состава
Презентация на тему Закон постоянства состава  Химическая связь
Химическая связь Окислительновосстановительные реакции. 9 класс
Окислительновосстановительные реакции. 9 класс