долю приходится
примерно половина
общей массы всех
элементов земной
коры.
Состав воздуха:
О2 – 20-21 %; N2 – 78%; CO2 – 0,03%,
остальное приходится на инертные газы, пары воды, примеси.
4. В земной коре его 49% по массе,
в гидросфере – 89% по массе.
5. В составе воздуха (в виде простого
вещества) – 20-21% по объёму.
6. Входит в состав большинства минеральных
и горных пород (песок, глины, и др). В составе
воздуха (в виде простого вещества).
7. Жизненно важный элемент для всех
организмов, содержится в большинстве
органических веществ, участвует во многих
биохимических процессах, обеспечивающих
развитие и функционирование жизни.
8. Кислород открыт в 1769-1771 гг. шведским
химиком К.-В. Шееле






 Классификация методов переработки пластмасс
Классификация методов переработки пластмасс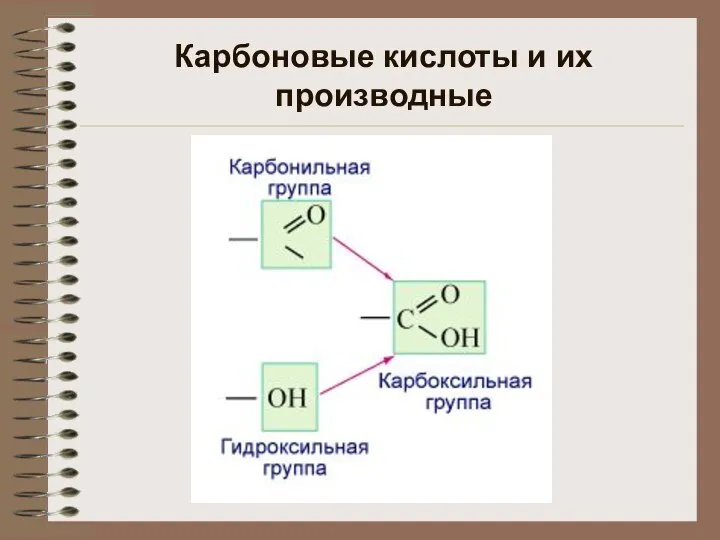 Карбоновые кислоты и их производные
Карбоновые кислоты и их производные Химия и производство
Химия и производство Природные источники углеводородов
Природные источники углеводородов Сырьё для каменного литья и производства минеральной ваты
Сырьё для каменного литья и производства минеральной ваты Лекарственные вещества (определения и классификация)
Лекарственные вещества (определения и классификация) Серная кислота
Серная кислота Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Первое начало термодинамики (Закон сохранения и превращения энергии)
Первое начало термодинамики (Закон сохранения и превращения энергии) Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 Реакции соединения
Реакции соединения Химическая технология органических веществ
Химическая технология органических веществ Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса
Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса Металлическая связь_1
Металлическая связь_1 Галогены
Галогены Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Теория строения химических соединений
Теория строения химических соединений Ионная хроматография
Ионная хроматография Выполнил ученик 9-го класса Сенов Виктор 2007-2008уч.год
Выполнил ученик 9-го класса Сенов Виктор 2007-2008уч.год Ферсман Александр Евгеньевич Очарованный камнем
Ферсман Александр Евгеньевич Очарованный камнем Разбор заданий на амины
Разбор заданий на амины Органические вещества
Органические вещества Химические и физические свойства воды
Химические и физические свойства воды Чистые вещества и смеси. Классификация веществ. Оксиды
Чистые вещества и смеси. Классификация веществ. Оксиды Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов
Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов Разработка математического описания расчета октанового числа бензинов каталитического риформинга с групповой кинетикой
Разработка математического описания расчета октанового числа бензинов каталитического риформинга с групповой кинетикой Презентация на тему Влияние химических веществ на рост и развитие растений
Презентация на тему Влияние химических веществ на рост и развитие растений  Строение атома. Планетарная модель атома Резерфорда
Строение атома. Планетарная модель атома Резерфорда