Слайд 2Вопросы для повторения:
Что такое количество вещества?
Какие реакции называют экзотермическими, какие

– эндотермическими?
Какие реакции называют гомогенными, какие – гетерогенными?
4. Назовите признаки химических реакций
5. Дайте определение скорости (в механике)
Слайд 6 Концентрацию веществ (С) измеряют в единицах количества вещества – моль -

(реагента или продукта) в единице объема в литрах (л), т.е. в моль/л
Скорость химической реакции (v) – моль/(л*с)
Слайд 8Карточка 1
От каких факторов зависит скорость химических реакций?
(Гипотеза):
______________________________________________________________________________
_____________________________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
5. ______________________________________________________________________________

Слайд 9Факторы, влияющие на скорость химической реакции:
Природа реагирующих веществ
Температура
Концентрация реагирующих веществ
Площадь соприкосновения реагирующих

веществ
Наличие катализатора
Слайд 10Карточка 2
Фактор №1. Природа реагирующих веществ
Fe + HCl →
Zn +

HCl →
Какая реакция протекает быстрее? Почему?
__________________________________________________
___________________________________________________
Zn + HCl →
Zn + CH3COOH →
Какая реакция протекает быстрее? Почему?
______________________________________________________________________________
_______________________________________________________________________________
Слайд 11Карточка 3
Фактор №2. Температура
Лабораторный опыт 1
CuO + H2SO4 →
Лабораторный опыт 2
CuO +

H2SO4 (нагревание) →
Что наблюдаете? - ___________________
Какая реакция протекает быстрее? - _________________________________________________________________________
Слайд 12Карточка 4
Фактор №3. Концентрация реагирующих веществ
Лабораторный опыт 1
Zn + HCl (концентриров.) →

Лабораторный опыт 2
Zn + HCl (разбавленная) →
Какая реакция протекает быстрее? Почему?
___________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________
Слайд 13Карточка 5
Фактор №4. Площадь соприкосновения
реагирующих веществ
Лабораторный опыт 1
CaCO3 (кусочек) +

HCl →
Лабораторный опыт 2
CaCO3 (порошок) + HCl →
Какая реакция протекает быстрее? Почему?
______________________________________________
______________________________________________
Слайд 14Фактор №5. Наличие катализатора
Катализатор – вещество, которое при добавлении в незначительном количестве

существенно изменяют скорость химической реакции, но не входит в состав продуктов.
Увеличение скорости химической реакции в присутствии катализатора называют катализом
Катализатор:
Ускоряет химическую реакцию
Может изменять направление реакции
Для обратимых реакций ускоряет и прямую, и обратную реакции
Слайд 15Карточка 6
Фактор №5. Наличие катализатора
Лабораторный опыт
+MnO2
2 H2O2 = 2 H2O +

O2↑
Что наблюдаем?____________________________
Исчез ли черный порошок оксида марганца (IV)? ___________________________________________
Слайд 16Задание 1
Укажите, какие из приведенных реакций являются гетерогенными, а какие — гомогенными?

Какая реакция протекает с наибольшей скоростью?
а) Zn + 2 HCl(p-p) → ZnCl2 + H2↑
б) 2 КОН(р-р) + H2SO4(p-p) → K2SO4 + 2 H2O
в) Ca(OH)2(р-р) + CO2 → CaCO3↓ + H2O
Слайд 17Задание 2
Предложите способы увеличения скорости реакции
4 FeS2(тв) + 11 O2 = 2Fe2O3

+ 8 SO2↑
Обоснуйте ваши выводы
Слайд 18Задание 3
В пробирки с гранулами Zn, Fe и Mg прилили 10%-ный раствор

соляной кислоты. В какой пробирке скорость реакции будет:
а) максимальной
б) минимальной
Ответ поясните
Слайд 19Домашнее задание
1. §3 учебника, задания 1, 2, 4 – устно, 3, 5

– письменно
2. Найдите в интернете видео опыта каталитической реакции, укажите, какой катализатор был использован для ее проведения


















 Простагландины. Воздействие фосфолипаз на фосфолипид
Простагландины. Воздействие фосфолипаз на фосфолипид Органическая химия: пищевые добавки
Органическая химия: пищевые добавки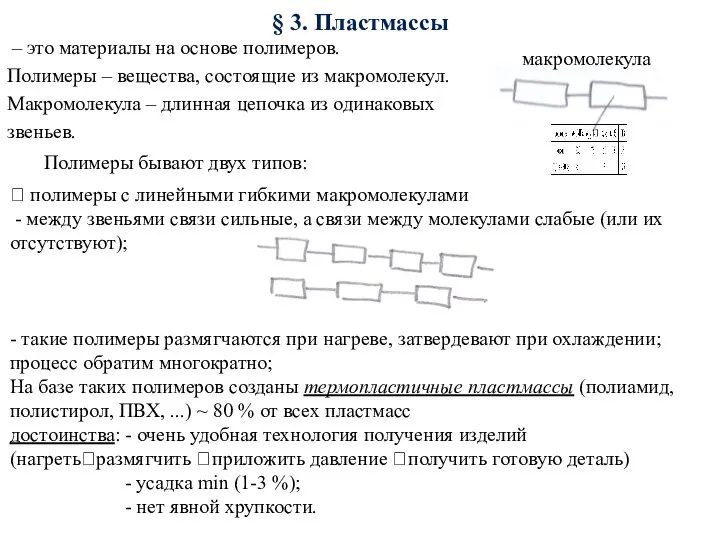 Пластмассы. Материалы, устойчивые против агрессивой среды
Пластмассы. Материалы, устойчивые против агрессивой среды Аминокислоты. Пептиды
Аминокислоты. Пептиды Искусственные полимеры
Искусственные полимеры Основные понятия химии
Основные понятия химии Чистые вещества и смеси
Чистые вещества и смеси Масс-спектрометрия шерсти волка обыкновенного Canis lupus
Масс-спектрометрия шерсти волка обыкновенного Canis lupus Азот
Азот Как уберечь себя от опасности на уроках химии
Как уберечь себя от опасности на уроках химии Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа
Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа Азот
Азот Реакции обмена
Реакции обмена Презентация по Химии "Химический БРЕЙН-РИНГ"
Презентация по Химии "Химический БРЕЙН-РИНГ"  Газ тәрізді диэлектриктер. Пропан
Газ тәрізді диэлектриктер. Пропан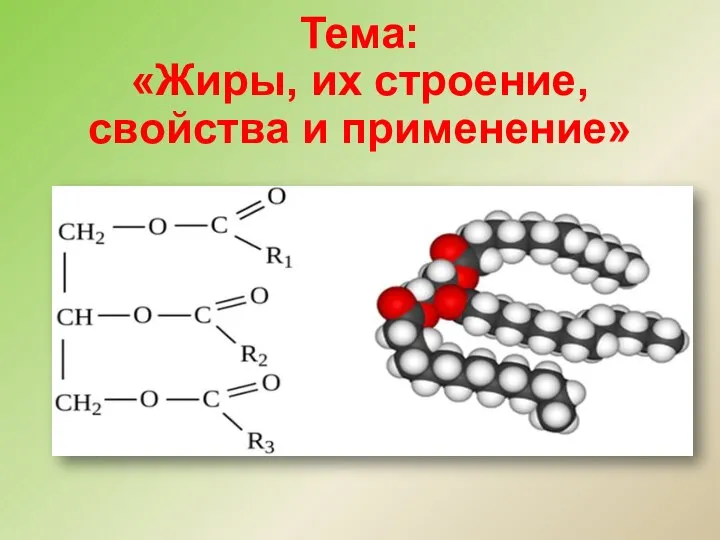 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Металлы. Общая характеристика
Металлы. Общая характеристика ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ. Презентация на тему Этиловый спирт и его влияние на здоровье человека
Презентация на тему Этиловый спирт и его влияние на здоровье человека  Галогены
Галогены Обмен и функции нуклеотидов
Обмен и функции нуклеотидов Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений Олово
Олово Цинк и его применение (11 класс)
Цинк и его применение (11 класс) Основы общей химии
Основы общей химии Основные понятия и законы химии
Основные понятия и законы химии Химия и жизнь
Химия и жизнь Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс