Слайд 2История открытия(четырежды открытый)
1) В 1764 г. в свинцовом руднике близ шотландской деревни

Стронциан был найден минерал, который назвали стронцианитом. В 1790г. английские минералоги Кроуфорд и Крюикшенк проанализировали этот минерал и установили, что в нем содержится новая «земля», а говоря нынешним языком, окисел.
2) Независимо от них тот же минерал изучал другой английский химик — Хоп. Придя к таким же результатам, он объявил, что в стронцианите есть новый элемент — металл стронций.
3) В те же годы на следы «стронциановой земли» натолкнулся и известный русский химик — академик Товий Егорович Ловиц. Его издавна интересовал минерал, известный под названием тяжелого шпата. Он начал систематически исследовать его и в 1792 г. пришел к выводу, что в этом минерале содержится неизвестная примесь. Результаты исследования были опубликованы в 1795 г.
4) Выдающийся ученый своего времени Хэмфри Дэви понимал уже, что элемент стронциановой земли должен быть, по-видимому, щелочноземельным металлом, и получил его электролизом. Дэви первым выделил чистый металл в 1808 г.
Слайд 3Строение атома Стронция(Sr)
Атом стронция состоит из положительно заряженного ядра (+38), внутри которого
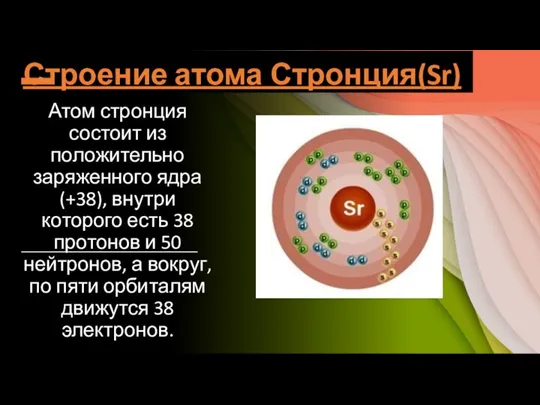
есть 38 протонов и 50 нейтронов, а вокруг, по пяти орбиталям движутся 38 электронов.
Слайд 4Физические свойства Стронция(Sr)
Стронций представляет собой ковкий золотисто-желтый металл, который легко режется ножом.

Летучие соединения стронция окрашивают пламя в карминово-красный цвет. Температура плавления 768°C,температура кипения 1390°C.
Слайд 5Получение Стронция(Sr)
Существуют три способа получения металлического стронция:
1)Термическое разложение некоторых соединений
2)Электролиз
3)Восстановление оксида или

хлорида
Основным промышленным способом получения металлического стронция является термическое восстановление его оксида алюминием.
Электролитическое получение стронция электролизом расплава смеси SrCl2 и NaCl не получило широкого распространения из-за малого выхода по току и загрязнения стронция примесями.
При термическом разложении гидрида или нитрида стронция образуется стронций, склонный к лёгкому воспламенению.
Слайд 6Химические свойства Стронция(Sr)
Стронций в своих соединениях всегда проявляет степень окисления +2.
В

электрохимическом ряду напряжений стронций находится среди наиболее активных металлов. Энергично реагирует с водой, образуя гидроксид: Sr + 2H2O → Sr(OH)2 + H2↑
Взаимодействует с кислотами, вытесняет тяжёлые металлы из их солей. С концентрированными кислотами (H2SO4, HNO3) реагирует слабо.
Металлический стронций быстро окисляется на воздухе, образуя желтоватую плёнку. При нагревании на воздухе загорается, порошкообразный стронций на воздухе склонен к самовоспламенению.
Энергично реагирует с неметаллами — серой, фосфором, галогенами. Взаимодействует с водородом (выше 200 °С), азотом (выше 400 °С). Практически не реагирует со щелочами.
При высоких температурах реагирует с CO2, образуя карбид:
5Sr + 2CO2 → SrC2 + 4SrO
Из-за высокой химической активности стронция его хранят в закрытой стеклянной посуде под слоем керосина.





 Общая характеристика элементов VII группы главной подгруппы. Хлор
Общая характеристика элементов VII группы главной подгруппы. Хлор Скорость химических реакций
Скорость химических реакций Квантовая химия
Квантовая химия Флэшмоб: Лаборатория на кухне
Флэшмоб: Лаборатория на кухне Магматические породы
Магматические породы Химические системы. Химическая термодинамика. Химическое равновесие
Химические системы. Химическая термодинамика. Химическое равновесие Безопасно ли пить воду из водопроводного крана?
Безопасно ли пить воду из водопроводного крана? Алюминий. Применение
Алюминий. Применение Материалы космической техники
Материалы космической техники Презентация на тему Химические свойства и применение алканов
Презентация на тему Химические свойства и применение алканов  Термодинамика. Лекция №2
Термодинамика. Лекция №2 Получение антибиотиков
Получение антибиотиков Презентация на тему Алкины. Ацетилен
Презентация на тему Алкины. Ацетилен  Чистые вещества и смеси. Классификация веществ. Оксиды
Чистые вещества и смеси. Классификация веществ. Оксиды Презентация на тему Сложные эфиры. Жиры
Презентация на тему Сложные эфиры. Жиры  Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение Щелочные металлы
Щелочные металлы Алюминий. Из истории открытия
Алюминий. Из истории открытия Оксиды. Проверка домашнего задания
Оксиды. Проверка домашнего задания romanchuk
romanchuk Химическая связь
Химическая связь Химия функциональных материалов. Адсорбция
Химия функциональных материалов. Адсорбция Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Комплексы хлорида и иодида цинка (II) с карбамидом: синтез, характеристика и биологическая активность
Комплексы хлорида и иодида цинка (II) с карбамидом: синтез, характеристика и биологическая активность Метелёва И.Е. учитель химии
Метелёва И.Е. учитель химии Презентация на тему Электролитическая диссоциация
Презентация на тему Электролитическая диссоциация  Соли: получение
Соли: получение Свойства химической связи
Свойства химической связи