Слайд 2Химическая реакция характеризуется качественным и количественным составом
Каковы массовые отношения?
2H2 +

O2 = 2H2O
4 а.е.м. 32 а.е.м. 36 а.е.м.
Каковы отношения числа частиц?
2H2 + O2 = 2H2O
2 молекулы 1 молекула 2 молекулы
Слайд 3Если химическую реакцию рассматривать с точки зрения числа частиц (атомов, молекул) то

применяют физическую величину «количество вещества»
- «НЮ» ( моль)
Слайд 4 Расскажу сегодня, что ли,
О зловредной роли моли.
Моль съедает шерсть и мех

–
Просто паника у всех….
Ну а в химии – изволь!
Есть другое слово “моль”
Прост, как небо и трава,
Моль любого вещества.
Но трудна его дорога:
В моле так частичек много!
Слайд 5Моль – единица количества вещества
Моль – это количество вещества, содержащее столько

же частиц (атомов, молекул), сколько содержится атомов углерода в 12 г углерода.
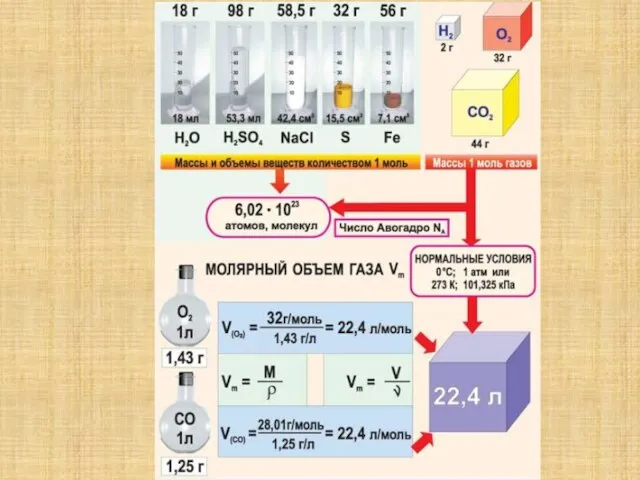
Слайд 61 моль любого вещества содержит
6,02 . 1023 молекул, атомов или других

частиц.
6,02 . 1023 - Число Авогадро
Слайд 10Молярная масса вещества – это масса 1 моля вещества
m
M (г/моль)

Слайд 111. Имеется 3 моль азотной кислоты. Сколько молекул азотной кислоты в этой

порции?
2. Какое количество вещества составляют
а) 3 x 1023 атомов серы;
б)12 x 1023атомов серы?
3) В какой порции углекислого газа и во сколько раз больше молекул?
а) 1 моль и 0,5 моль;
б) 0,5 моль и 0,25 моль?
Слайд 12Решить задачи:
№1
Дано: n(Fe2O3) = 1,5 моль
n (PCl3) = 0,5 моль
________________
N

(Fe2O3) - ?
N (PCl3) - ?










 Проблемы и меры по защите окружающей среды ПМР
Проблемы и меры по защите окружающей среды ПМР Углеводы. Полисахариды. Важнейшие представители
Углеводы. Полисахариды. Важнейшие представители Презентация на тему Обобщение сведений об основных классах неорганических веществ
Презентация на тему Обобщение сведений об основных классах неорганических веществ  Окислительно-восстаовительные реакции
Окислительно-восстаовительные реакции Зонная структура металлов, диэлектриков и полупроводников. Лекция 3
Зонная структура металлов, диэлектриков и полупроводников. Лекция 3 Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Изомерия
Изомерия Экстракция и кристаллизация
Экстракция и кристаллизация Вырсова И.Е.
Вырсова И.Е. Расчеты по химическим уравнениям реакций
Расчеты по химическим уравнениям реакций Определение Кофеина в Кофе
Определение Кофеина в Кофе Термопласты: основные представители, сравнение свойств и область их применения
Термопласты: основные представители, сравнение свойств и область их применения Строение атома
Строение атома Юные химики. Своя игра
Юные химики. Своя игра Генетич_связь_Проявление_периодического_закона
Генетич_связь_Проявление_периодического_закона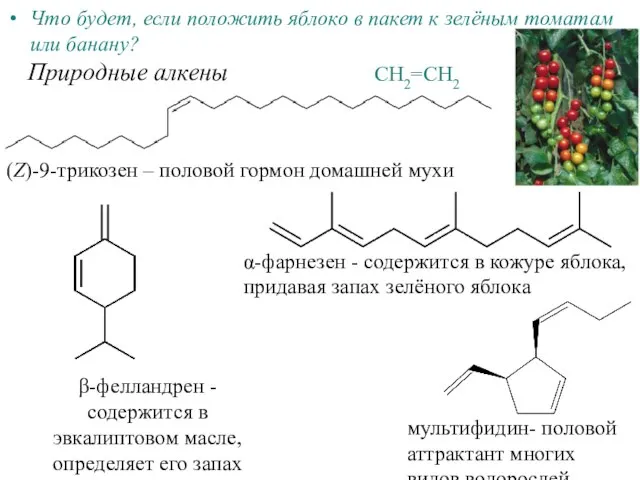 Алкены
Алкены Железо и его соединения. Строение атома железа
Железо и его соединения. Строение атома железа Основы химической кинетики
Основы химической кинетики Строение атома
Строение атома Презентация на тему Глюкоза (10 класс)
Презентация на тему Глюкоза (10 класс) 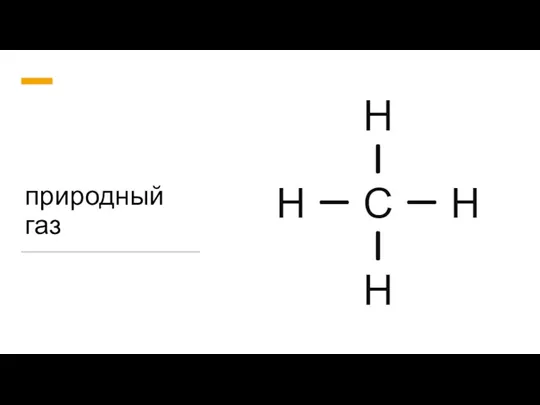 Природный газ
Природный газ История развития органической химии
История развития органической химии Хим_10_30_Производство_аммиака
Хим_10_30_Производство_аммиака Презентация на тему Водород
Презентация на тему Водород  Определение химической формулы металла по экспериментальным данным
Определение химической формулы металла по экспериментальным данным Щелочноземельные металлы
Щелочноземельные металлы Презентация на тему Интересные факты из жизни Д. И. Менделеева
Презентация на тему Интересные факты из жизни Д. И. Менделеева  Презентация на тему Ковалентная химическая связь
Презентация на тему Ковалентная химическая связь