Слайд 2Цели урока.
Познакомить учащихся с составом, названиями, классификацией и представителями класса кислот.
Продолжить знакомство

со сложными ионами на примере кислотных остатков кислородных кислот.
Продолжить формирование знаний о различиях между зарядами ионов и с.о. элементов, об индикаторах.
Слайд 3Актуализация опорных ЗУНов.
Что называется основаниями?
Какие реакции называются качественными?
Как изменяют окраску индикаторы в

щелочной среде?
Работа по группам:
1 группа – проверочная робота по теме «Основания».
2 группа – по учебнику выполнить упр 4, 6 стр. 70.
Слайд 4Развитие новых ЗУНов
Попробуйте кристаллики лимонной кислоты на вкус.
Он кислый, отсюда

и название класса (кислоты).
Но ни один химик и не один грамотный человек даже и не подумает распознавать таким образом кислоты –это может быть смертельно опасно!
Слайд 5Гораздо проще и безопаснее распознавать кислоты, как и щелочи, с помощью индикаторов
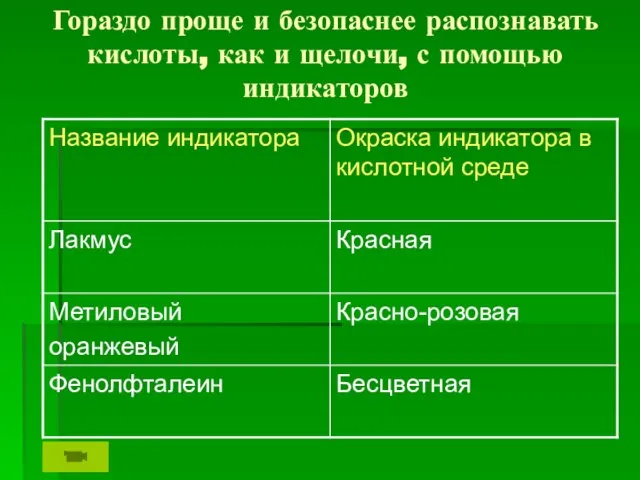
Слайд 6Кислоты
HCL – хлороводородная (соляная)
HNO3 - азотная
HNO2 - азотистая
H2SO4 - серная
H2SO3 - сернистая
H2S

- сероводородная
H3PO4 - фосфорная
H2CO3 - угольная
H2SiO3 - кремниевая
HBr - бромоводородная
HI - иодоводородная
HF – фтороводородная (плавиковая)
Слайд 7Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и

кислотных остатков
Слайд 8Классификация кислот
По числу атомов водорода:
а) одноосновные – HCL, HNO3, HNO2, HBr, HI,
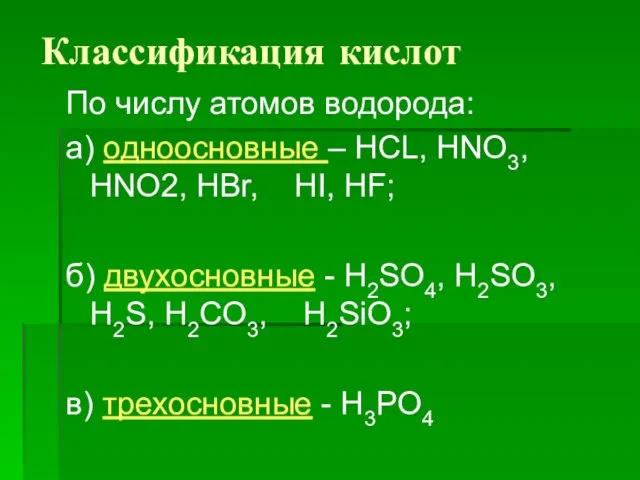
HF;
б) двухосновные - H2SO4, H2SO3, H2S, Н2CO3, H2SiO3;
в) трехосновные - H3PO4
Слайд 9 По наличию атомов кислорода в кислотных остатках:
а) кислородсодержащие - HNO3, HNO2,

H2SO4, H2SO3, Н2CO3, H3PO4, H2SiO3;
б) бескислородные - HCL, HBr, H2S.
Слайд 10По признаку растворимости:
а) растворимые - HNO3, HNO2, H2SO4, H2SO3, Н2CO3, H3PO4,

HCL, HBr, H2S;
б) нерастворимые - H2SiO3.
Слайд 11Степени окисления элементов и заряды ионов кислот
Кислоты это своеобразный мостик, который связывает

полярную ковалентную связь с ионной.
В растворах между водородом и кислотным остатком ковалентная связь переходит в ионную.
Кислоты образуют ионы двух видов: простые – ионы водорода Н+ и сложные – ионы кислотного остатка (SO42-, NO3-, PO43-)
Слайд 12Отличия между степенью окисления и зарядом иона.
Число видов степени окисления элементов

в соединениях равно числу элементов в составе вещества, число видов ионов равно числу частей вещества. Так, для H2SO4:
а) заряды ионов H2+SO42-;
б) с.о. элементов H2+1S+6O42-.
Слайд 13Представители кислот.
Техника безопасности при работе с кислотами.
HCL – хлороводородная (соляная)
HNO3 – азотная
H2SO4

- серная
Слайд 14Развитие новых ЗУНов.
Определите для кислоты: а) заряды ионов; б) с.о. элементов; в)

соответствующий ей оксид.
2. Какое количество вещества содержится в













 Знаки химических элементов. Периодическая система
Знаки химических элементов. Периодическая система Абсолютное первенство по химии - 2012
Абсолютное первенство по химии - 2012 Алкены (непредельные углеводороды)
Алкены (непредельные углеводороды) Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами
Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами Циклоалканы
Циклоалканы Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты
Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории
Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Как искупаться дома в морской воде?
Как искупаться дома в морской воде? Открытия в химии
Открытия в химии Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Карбонильные соединения – альдегиды
Карбонильные соединения – альдегиды Калифорний Cf
Калифорний Cf Действие активированного угля
Действие активированного угля Оксид кремния
Оксид кремния Ковалентная полярная связь
Ковалентная полярная связь Характеристика кислорода и серы
Характеристика кислорода и серы Химическая связь. Ковалентная связь
Химическая связь. Ковалентная связь Ароматические гетероциклические соединения
Ароматические гетероциклические соединения Учебник системы учебно-методических комплектов Алгоритм успеха
Учебник системы учебно-методических комплектов Алгоритм успеха Металлургия
Металлургия Азот N2
Азот N2 Качественная реакция на многоатомные спирты
Качественная реакция на многоатомные спирты Презентация на тему Катализ
Презентация на тему Катализ  Жиры. Открытие жиров
Жиры. Открытие жиров Каучук. Строение и применение
Каучук. Строение и применение каталитический крекинг
каталитический крекинг