Слайд 2Покорение химической вершины по теме «Количество вещества»
Т.о., как вы понимаете, сегодня на

уроке мы покоряем химическую вершину по теме «Количество вещества».
Наша цель: научиться самостоятельно решать задачи по теме урока. Это - вершина нашего урока.
Слайд 3 Но само собой этот умение не придет.
Как выдумаете, что поможет

в решении задач?
Слайд 4Знание понятий: моль, количество вещества, молярная масса, число Авогадро
Знание формул
Умение

выводить производные от формул
Умение грамотно оформить задачу
Умение решать задачу по образцу
Умение решать задачу самостоятельно
Проверка знаний ранее изученного материала
Слайд 5 ТЕСТИРОВАНИЕ
I вариант – металлы II вариант – неметаллы
Из приведенных ниже

предложений выпишите только те, которые соответствуют; I вариант-металлам; II вариант- неметаллам.
1.Агрегатное состояние: твердое.
2. Электропроводны.
3.Ковкие.
4.Пластичные.
5.Имеют металлический блеск.
6.Не имеют металлического блеска.
7.Нетеплороводные.
8.Газообразные.
9.В твёрдом состоянии-хрупкие
Слайд 6 Ключ:
Вариант I: 1, 2, 3, 4, 5.
Вариант II: 1, 6, 7,

8, 9.
Слайд 9Задача 1.
Вычислить относительную молекулярную массу сахара (с12 Н22 О11)

Слайд 10Решение:
Mr(C12 H22 O11) =
=12х12+1х22+16х11=342
М(С12 H22 O11)= =342г/моль

Слайд 11Задача 2.
Сколько молекул содержится в 2 молях воды?

Слайд 12Самостоятельное решение расчетных задач.

Слайд 13Домашнее задание:
пар.15-16.
1.Реши одну из предложенных задач
Рассчитайте количество вещества углекислого газа, в котором

содержится 36х1023 молекул
Какую массу имеют 3х1023 молекул кислорода (O2)
Какую массу имеют 1,5 моль оксида серы (IV)?
Придумай задачу на определение массы, через количество вещества и реши ее.
Слайд 14Подведение итогов урока
Покорили ли мы вершину «Количество вещества» и можно ли

нам двигаться дальше.
Рефлексия -Что мы узнали сегодня нового?
– Что мы научились выполнять?
– Какие были затруднения?
– Что показалось самым интересным?
– Что удивило вас?






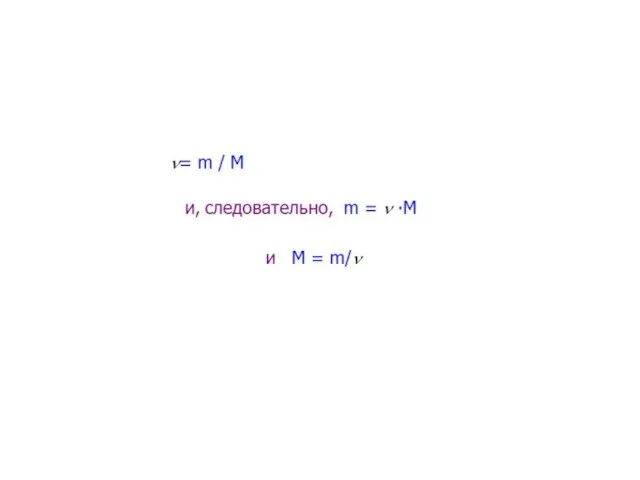






 Презентация на тему Неметаллы
Презентация на тему Неметаллы  Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Презентация на тему Знаешь ли ты классы неорганических веществ
Презентация на тему Знаешь ли ты классы неорганических веществ  Презентация на тему Твердые вещества
Презентация на тему Твердые вещества  Презентация на тему Ролевая игра "Суд над этанолом"
Презентация на тему Ролевая игра "Суд над этанолом"  Химическая связь
Химическая связь Презентация на тему Влияние пищевых добавок на здоровье человека
Презентация на тему Влияние пищевых добавок на здоровье человека  Химия, химия, химия!
Химия, химия, химия! Производные фенола: танины
Производные фенола: танины Карбоновые кислоты
Карбоновые кислоты Химия на войне
Химия на войне Общая характеристика криптона
Общая характеристика криптона Биосинтез фенольных соединений в растениях
Биосинтез фенольных соединений в растениях Углеводороды
Углеводороды Карбораны. Особенности строения молекулы. Получение и химические свойства
Карбораны. Особенности строения молекулы. Получение и химические свойства Строение органических веществ
Строение органических веществ Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Природные источники углеводородов. Нефть и природный газ
Природные источники углеводородов. Нефть и природный газ Презентация на тему Химия и пища
Презентация на тему Химия и пища  Биохимия, как наука
Биохимия, как наука Металлическая химическая связь
Металлическая химическая связь Общая характеристика металлов
Общая характеристика металлов Органические вещества
Органические вещества 1.2. Измерения веществ
1.2. Измерения веществ Решение расчетных задач
Решение расчетных задач Сплавы металлов (познавательная презентация)
Сплавы металлов (познавательная презентация) Водород
Водород Изомерия. Классификация органических веществ.
Изомерия. Классификация органических веществ.