Содержание
- 2. ИМЕЮТ ЛИ ВЕС АТОМЫ И КАК ЕГО ИЗМЕРИТЬ? Джон Дальтон (1766-1844) английский физик и химик ,
- 3. МАССЫ АТОМОВ НИЧТОЖНО МАЛЫ Масса самого лёгкого атома водорода 0,000 000 000 000 000 000 000
- 4. АБСОЛЮТНАЯ И ОТНОСИТЕЛЬНАЯ МАССА Иногда используются не абсолютные, а относительные величины ; например, диетологи , чтобы
- 5. АТОМНАЯ ЕДИНИЦА МАССЫ m(1 а.е.м.)=0,00000000000000000000000000166кг=1,66 ×10 -27кг ma(H)=1 а.е.м. ma(He)=4 а.е.м.
- 6. ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА -АR Аr показывает во сколько раз масса атома элемента больше 1/12 части массы
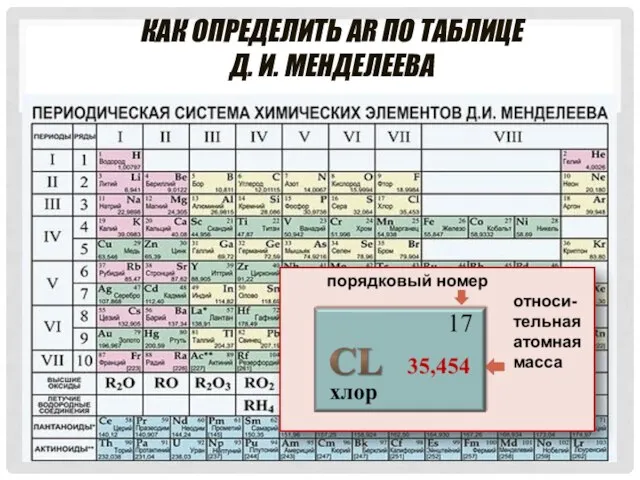
- 7. КАК ОПРЕДЕЛИТЬ АR ПО ТАБЛИЦЕ Д. И. МЕНДЕЛЕЕВА
- 8. ЗНАЧЕНИЯ ОТНОСИТЕЛЬНЫХ АТОМНЫХ МАСС НЕКОТОРЫХ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ водород 1 1,00797 кислород углерод 15,9994 12,01115 8 6
- 9. ДРОБНОЕ ЗНАЧЕНИЕ АR хлор 17 35,454 В расчётах используют значения относительных атомных масс , округлённые до
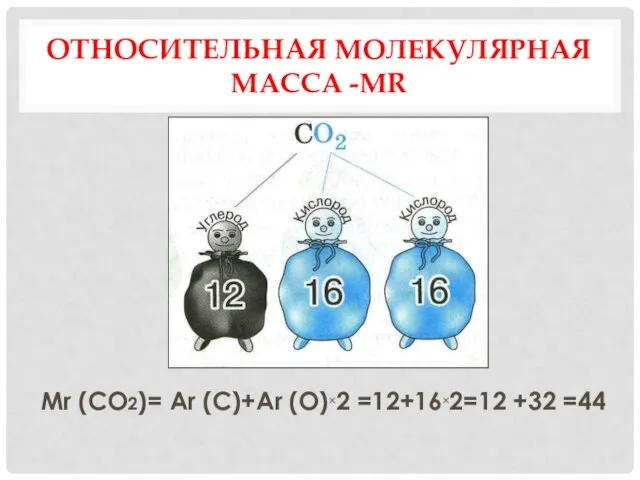
- 10. ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА -МR показывает во сколько раз масса молекулы вещества больше 1/12 массы атома углерода
- 11. ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА -МR Mr (CO2)= Ar (C)+Ar (O)×2 =12+16×2=12 +32 =44
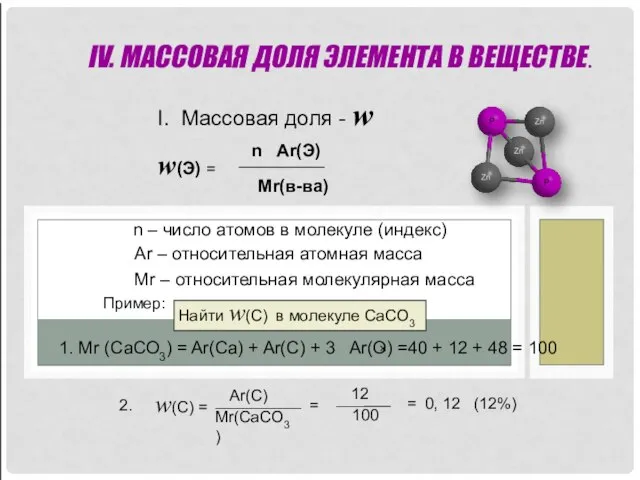
- 12. IV. МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА В ВЕЩЕСТВЕ. I. Массовая доля - w w(Э) = n Ar(Э) Mr(в-ва)
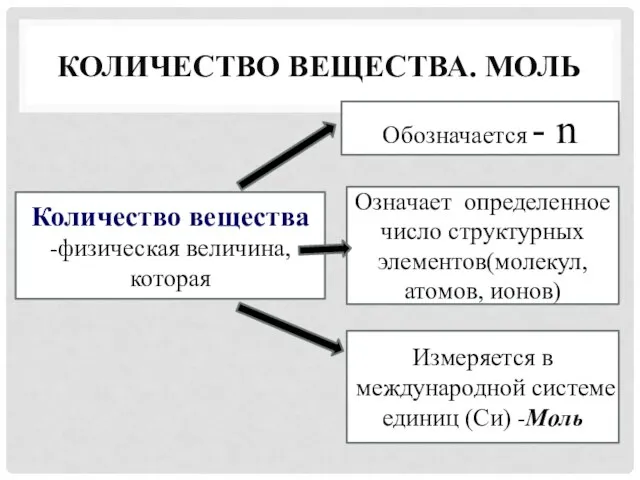
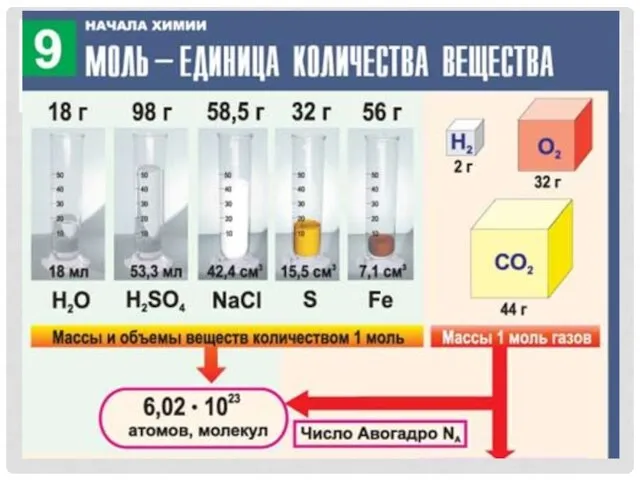
- 13. КОЛИЧЕСТВО ВЕЩЕСТВА. МОЛЬ Количество вещества -физическая величина, которая Обозначается - n Означает определенное число структурных элементов(молекул,
- 15. Моль – это единица, которой в химии измеряют количество вещества; число частиц, содержащихся в 1 г
- 16. ЕДИНИЦА ИЗМЕРЕНИЯ
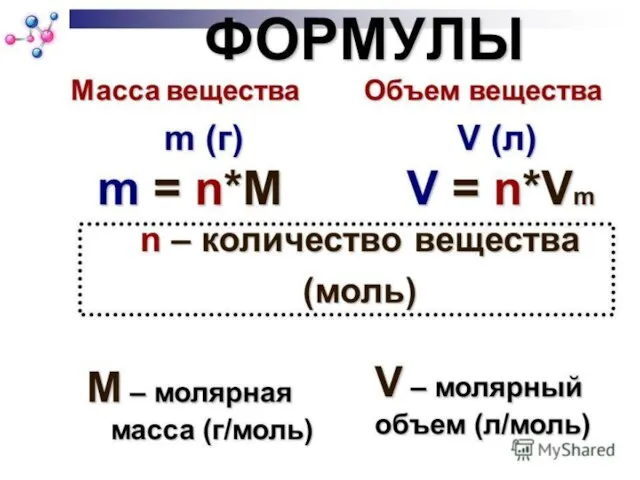
- 17. n=m/М n=N/Na n=V/Vm
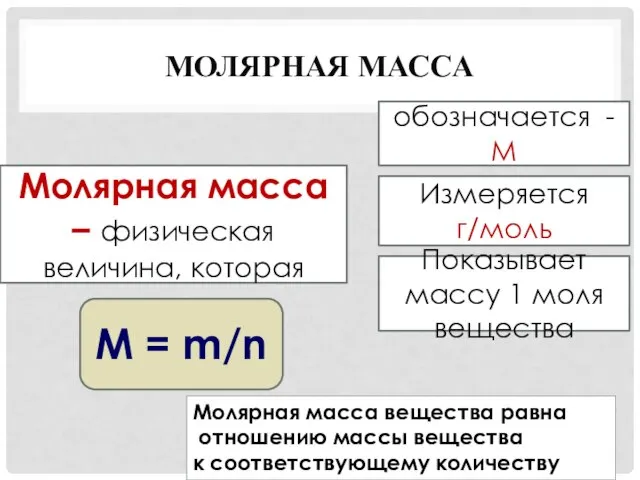
- 18. МОЛЯРНАЯ МАССА Молярная масса – физическая величина, которая обозначается - М Измеряется г/моль Показывает массу 1
- 19. МОЛЯРНАЯ МАССА - ЭТО постоянная величина; масса 1 моля вещества, молярные массы разных веществ различны; масса
- 20. Примеры: Чтобы отмерить 1 моль вещества, нужно взять столько грамм, какова Ar или Mr вещества n=m:M
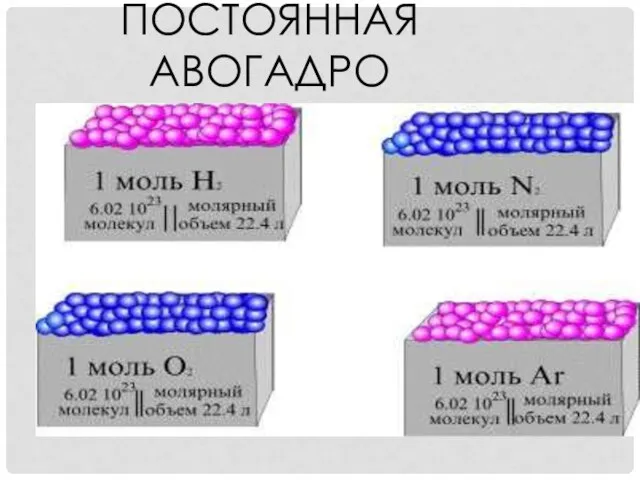
- 25. ПОСТОЯННАЯ АВОГАДРО Это число частиц, которое содержится в одном моль любого вещества. Обозначение числа Авогадро NA
- 26. ПОСТОЯННАЯ АВОГАДРО - ЭТО переменная величина; число частиц, содержащихся в одном моль вещества; 6,02*1023 молекул, атомов,
- 27. ПОСТОЯННАЯ АВОГАДРО
- 28. МОЛЯРНЫЙ ОБЪЕМ объем 1 моля газа при н.у.; всегда равен 22,4 л/моль. объем, который занимает 6,02*1023
- 29. МОЛЯРНЫЙ ОБЪЕМ V=Vm·n V=m:ρ n =V/ Vm m=M· V/ Vm
- 31. ДОМАШНЕЕ ЗАДАНИЕ Ерохин, Ю. М. Химия для профессий и специальностей технического и естественно-научного профилей: учебник для
- 33. Скачать презентацию






















 Презентация на тему А.М. Бутлерова
Презентация на тему А.М. Бутлерова  Чемпионат НХЛ (национальной химической лиги)
Чемпионат НХЛ (национальной химической лиги) Многогранность- моё второе имя. Задача
Многогранность- моё второе имя. Задача Металлы и неметаллы
Металлы и неметаллы Электролиз
Электролиз Природные источники углеводородов
Природные источники углеводородов Спирты. Строение
Спирты. Строение Презентация на тему В мире индикаторов - исследовательская работа
Презентация на тему В мире индикаторов - исследовательская работа  Расчеты по химическим уравнениям реакций
Расчеты по химическим уравнениям реакций Судың диссоциациясы
Судың диссоциациясы Классификация и номенклатура аминов. 11 класс
Классификация и номенклатура аминов. 11 класс Group 6 Cations
Group 6 Cations Спирты (10 класс)
Спирты (10 класс) Бинарные соединения
Бинарные соединения Алканы. Этан - C₂H₆
Алканы. Этан - C₂H₆ 1_
1_ Азот
Азот Металлы. Общие свойства
Металлы. Общие свойства 14257fc50bc406ef33f49ad14aa3f48b
14257fc50bc406ef33f49ad14aa3f48b Алкины
Алкины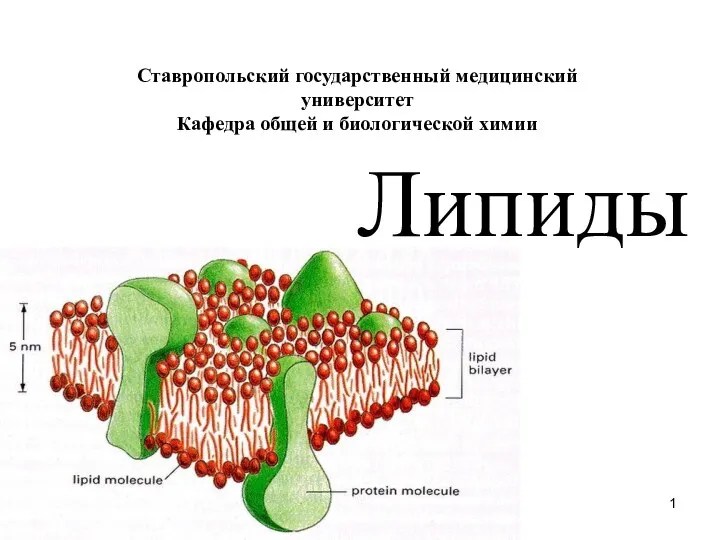 Липиды
Липиды Ковалентная неполярная связь
Ковалентная неполярная связь Степень окисления
Степень окисления Кислоты в химии
Кислоты в химии Основания, их состав и название
Основания, их состав и название Особенности формирования естественно-научной картины мира на уроках географии и химии
Особенности формирования естественно-научной картины мира на уроках географии и химии Моделирование фазовых систем. Тройные взаимные системы
Моделирование фазовых систем. Тройные взаимные системы Метил-трет-бутиловый эфир
Метил-трет-бутиловый эфир