Слайд 2Оксиды
Образованы двумя химическими элементами
Один из элементов кислород, имеющий степень окисления

-2
Примеры: MgO, H2O
Слайд 3Оксидами являются оба вещества в паре
1)MgO и H2O2
2)Na 2O2 и BaO
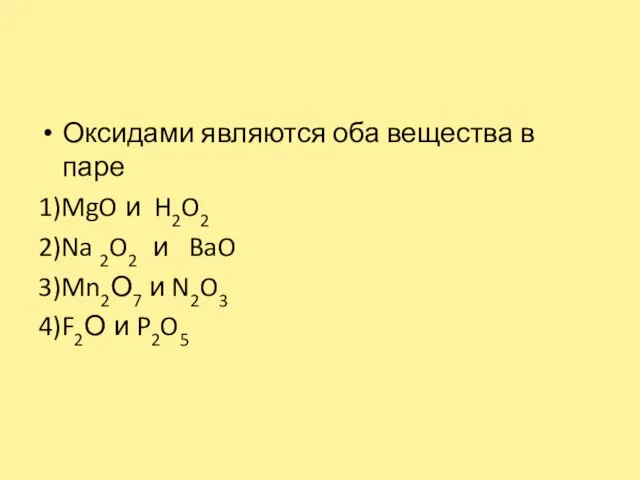
3)Mn2О7 и N2O3
4)F2О и P2O5
Слайд 4Классификация оксидов
Несолеобразующие (безразличные)
NO
CO
N2O
Солеобразующие
Основные
Кислотные
Амфотерные

Слайд 5Основные оксиды
Оксиды металлов, в которых металл имеет степень окисления +1 или +2

как правило
Основным оксидам соответствуют основания (основные гидроксиды):
Na2O – NaOH
MgO – Mg(OH)2
Слайд 6Свойства основных оксидов
Реагируют с кислотами:
MgO + H2SO4 = MgSO4 +

H2O
Некоторые реагируют с водой (оксиды щелочных и щелочно-земельных металлов):
Na2O + H2O = 2NaOH
Реагируют с кислотными оксидами:
CaO + CO2 = CaCO3
Слайд 7Кислотные оксиды
Оксиды неметаллов и металлов, в которых элемент имеет степень окисления

+4 и выше как правило
Кислотным оксидам соответствуют кислоты (кислотные гидроксиды):
CO2 – H2CO3 Mn2O7 – HMnO4
SO3 – H2SO4 CrO3 – H2CrO4, H2Cr2O7
Слайд 8Свойства кислотных оксидов
Реагируют со щелочами (растворимыми в воде основаниями):
CO2 + 2NaOH

= Na2CO3 + H2O
Большинство реагирует с водой:
SO3 + H2O = H2SO4
Реагируют с основными оксидами:
P2O5 + 3CaO = Ca3(PO4)2
Слайд 9Амфотерные оксиды
Оксиды металлов, в которых металл проявляет степень окисления +3 или

+4 как правило
Амфотерным оксидам соответствуют амфотерные гидроксиды:
Al2O3 – Al(OH)3 ZnO – Zn(OH)2
Cr2O3 – Cr(OH)3 BeO – Be(OH)2
MnO2 – Mn(OH)4
Слайд 10Свойства амфотерных оксидов
Амфотерность – двойственность свойств
Реагируют с кислотами, проявляя свойства основных

оксидов:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Реагируют со щелочами, проявляя свойства кислотных оксидов:
Al2O3 + 2NaOH + 3H2O= 2Na[Al(OH)4]
Al2O3 + 2NaOH = 2NaAlO2 + H2O (при сплавлении)
Слайд 11С водой реагируют оксиды:
1)BaO и SiO2
2)СuO и SO3
3)BaO и SO3
4)FeO и

СО2
Слайд 12Оксид серы (IV) взаимодействует с каждым из двух веществ:
1)H2O и KCl
2)Ba(OH)2 и

CaO
3)CaCO3 и ZnSO3
4)Ca(OH)2 и N2
Слайд 13С соляной кислотой реагируют каждый из двух оксидов
1)K2O и SO3
2)Al2O3 и CaO

3)CO2 и ZnO
4)CrO3 и Na2O
Слайд 14И с раствором гидроксида натрия и с серной кислотой реагирует
1)ВаO

2) Cr2O3
3) SiO2
4) MgO
Слайд 15Гидроксиды
Основные – основания (щелочи и нерастворимые в воде)
Кислотные – кислоты кислородсодержащие
Амфотерные

Слайд 16Только кислоты расположены в ряду
1)HNO3, Ca(NO3)2, NO2
2)KHCO3, Ba(HSO4)2, Zn(OH)Cl
3)HNO2, HNO3, CH3COONa
4)H2S, Н2SO3,

CH3COOH
Слайд 17Оцените правильность следующих суждений:
А) Гидроксиды по свойствам делятся на кислоты, основания и

амфотерные гидроксиды.
Б) Гидроксиды элементов главных подгрупп первой и второй групп Периодической системы – растворимые основания (щелочи).
1)верно только А
2)верно только Б
3)верны оба суждения
4)оба суждения неверны
Слайд 18Щелочи – растворимые в воде основания
Щелочи образуют металлы 1 группы главной подгруппы

(щелочные металлы) и щелочноземельные металлы (Ca, Sr, Ba)
Примеры: NaOH, Ca(OH)2
Слайд 19Свойства щелочей
Реагируют с кислотами:
2NaOH + H2SO4 = Na2SO4 + 2H2O
Реагируют с

кислотными оксидами:
2NaOH + CO2 = Na2CO3 + H2O
Реагируют с растворами солей, если выпадает осадок:
2NaOH+ CuSO4 = Cu(OH)2↓ + Na2SO4
Реагируют с металлами, образующими амфотерные оксиды и гидроксиды:
2NaOH + Zn +2H2O = Na2[Zn(OH)4] + Н2
Слайд 20Нерастворимые в воде основания
Реагируют с кислотами:
Mg(OH)2 + 2HNO3 = Mg(NO3)2 +2H2O
Разлагаются при
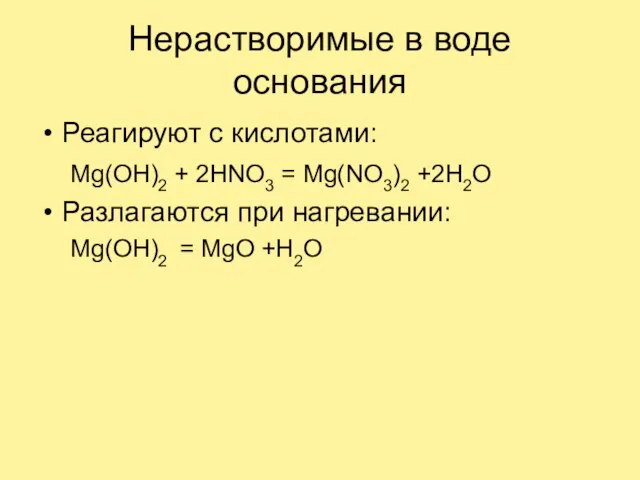
нагревании:
Mg(OH)2 = MgO +H2O
Слайд 21Кислотные гидроксиды – кислородсодержащие кислоты
Реагируют с основаниями:
KOH + HNO3 = KNO3 +

H2O
Реагируют с основными оксидами:
MgO + H2SO4 = MgSO4 + H2O
Реагируют с металлами, стоящими в ряду напряжений до водорода:
Mg + H2SO4 = MgSO4 + H2
Реагируют с солями:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2
Слайд 22Амфотерные гидроксиды
Реагируют с кислотами, проявляя свойства оснований:
Al(OH)3 + 3HCl = AlCl3 +

3H2O
Реагируют со щелочами, проявляя свойства кислот:
Al(OH)3 + NaOH = Na[Al(OH)4]
Слайд 23Гидроксид натрия не взаимодействует с
1)CuCl2
2)SO2
3)PbS
4)HNO3

Слайд 24Гидроксид натрия реагирует со всеми веществами ряда:
1)Zn, Na 2CO3, CuO
2)CO2, H3 PO4

CuO
3)S O3, H3PO 4, AI2O3
4)SO3, MgO, H3PO4,
Слайд 25Гидроксид калия реагирует со всеми веществами группы
1)Zn, SiO2, H2O
2)HNO3, Na2CO3, Mg
3)CuSO4, SO3,

H3PO4
4)CuO, Cа(OH)2, N2O5
Слайд 26В ряду превращений:
CuO→CuCl2→Cu(OH)2 вещества X и Y соответственно
1)НСl и

NaOH
2)HCl и Fe(OH)3
3)NaCl и Н2O
4)Cl2 и H2O
Слайд 27В ряду превращений
NaOH→Na 2CO3→CO2
веществa X и Y соответственно
1)Н2CO3
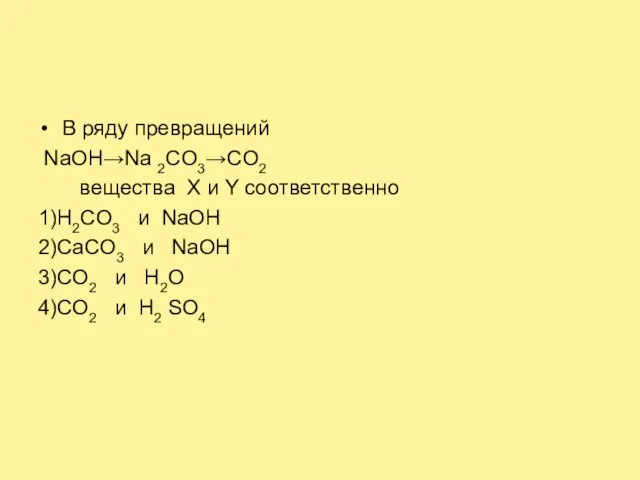
и NaOH
2)CaCO3 и NaOH
3)CO2 и H2O
4)CO2 и H2 SO4
Слайд 28Каждое из перечисленных веществ: CuCl2, SO3, H3PO4, Zn(OH)2
реагирует с
1)серной кислотой 2)водой

3)гидроксидом натрия 4)оксидом углерода(VI)
Слайд 29 При действии избытка раствора гидроксида натрия на раствор сульфата цинка образуется
1)

ZnO
2) Zn(OH)2
3) Na2ZnO2
4)Na2[Zn(OH)4]




























 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Синтетическое моторное масло. Маркировка моторных масел
Синтетическое моторное масло. Маркировка моторных масел Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера
Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера Спирты
Спирты Гранулометричний склад матеріалу і його характеристики
Гранулометричний склад матеріалу і його характеристики Прогнозирование возможности и направления протекания самопроизвольных процессов
Прогнозирование возможности и направления протекания самопроизвольных процессов Растворы и их концентрация. Массовая доля растворенного вещества
Растворы и их концентрация. Массовая доля растворенного вещества Слідство ведуть знавці
Слідство ведуть знавці Каучук. История открытия каучука
Каучук. История открытия каучука Вода и ее свойства
Вода и ее свойства Պոլիմերներ
Պոլիմերներ Атомы химических элементов
Атомы химических элементов Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"
Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"  Ионные реакции
Ионные реакции Методы разделения и очистки веществ
Методы разделения и очистки веществ Электролитическая диссоциация
Электролитическая диссоциация Образование и получение веществ. Естествознание 6 класс
Образование и получение веществ. Естествознание 6 класс Физические свойства
Физические свойства Взаимодействие частиц конденсированной фазы, их срастание (коалесценция). Лекция 3
Взаимодействие частиц конденсированной фазы, их срастание (коалесценция). Лекция 3 Основи масообміну
Основи масообміну Окислительные свойства концентрированной серной кислоты
Окислительные свойства концентрированной серной кислоты Типичные реакции основных и кислотных оксидов
Типичные реакции основных и кислотных оксидов Презентация по Химии "Анилин"
Презентация по Химии "Анилин"  Соли. Составление формул и номенклатура
Соли. Составление формул и номенклатура teoriya_elektroliticheskoy_dissotsiatsii
teoriya_elektroliticheskoy_dissotsiatsii Этанол. Химические свойства этанола
Этанол. Химические свойства этанола Строение атома
Строение атома Кислородсодержащие органические соединения
Кислородсодержащие органические соединения