Содержание
- 2. Соли – сложные вещества, состоящие из атомов металла, соединённых c кислотным остатком. Общая формула класса: MenAm
- 3. Соли CuSO4 CaCO3(мел) KMnO4 FeCl3
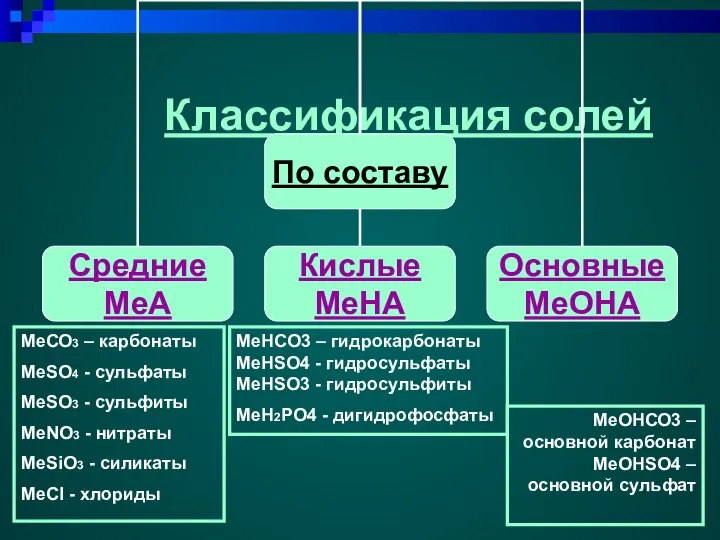
- 4. Классификация солей МеСО3 – карбонаты МеSO4 - сульфаты MeSO3 - сульфиты MeNO3 - нитраты MeSiO3 -
- 5. Классификация солей K4[Fe(CN)6] Na[Al(OH)4] KAl(SO4)2 алюмокалиевая CaOCl2 Хлорная известь
- 6. Выбрать формулы солей: KNO3 NaHCO3 P2O5 PbCl2 ZnOHCl Mg(OH)2 H3PO4 Na2SO4 CaH2PO4 CO2
- 7. Назвать: NaCl BaI2 FeSO4 AlPO4 Ca(NO3)2 CuCO3 Cr2S3 CuHCO3 CuOHCO3
- 8. Составить формулы солей: а) силикат натрия б) фторид алюминия в) сульфат меди(II) г) нитрит железа (III)
- 9. Получение солей 1. Реакция нейтрализации: Ca(OH)2 + H2SO3 = = CaSO3 + 2H2O сульфит кальция
- 10. Получение солей 2. Взаимодействие металлов с неметаллами: 2Al + 3S = Al2S3 сульфид алюминия
- 11. Получение солей 3. Взаимодействие металлов с кислотами: Zn + 2HCl = ZnCl2 + H2 хлорид цинка
- 12. Получение солей 4. Взаимодействие основных оксидов с кислотными оксидами. CaO + SiO2 = CaSiO3 силикат кальция
- 13. Физические свойства солей Соли, за небольшим исключением, являются твёрдыми кристал-лическими веществами различного цвета. По растворимости в
- 14. Химические свойства солей Соли взаимодействуют: C простыми веществами – металлами и неметаллами. со сложными – кислотами,
- 15. Химические свойства солей 1. С металлами: CuSO4 + Fe = FeSO4 + Cu сульфат меди (II)
- 16. Химические свойства солей 3. С кислотами: 2NaCl + H2SO4 = хлорид натрия = Na2SO4 + 2HCl
- 17. Химические свойства солей 4. С щелочами: FeCl2 + 2NaOH = хлорид железа (II) =Fe(OH)2 + 2NaCl
- 18. Химические свойства солей 5. С солями: AgNO3 + KCl = нитрат серебра =AgCl + KNO3 хлорид
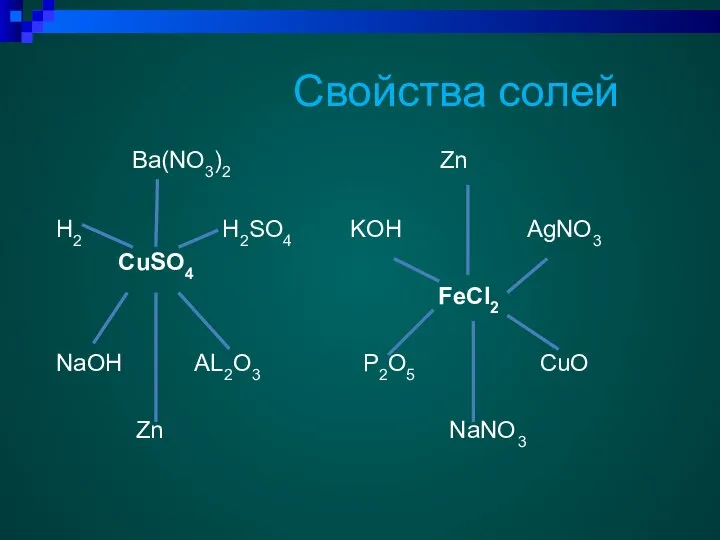
- 19. Свойства солей Ba(NO3)2 Zn H2 H2SO4 KOH AgNO3 CuSO4 FeCl2 NaOH AL2O3 P2O5 CuO Zn NaNO3
- 20. Применение солей Многие соли применяют в быту (поваренная соль, сода), в качестве минеральных удобрений, при производстве
- 21. NaCl
- 22. CaCO3
- 24. Скачать презентацию


![Классификация солей K4[Fe(CN)6] Na[Al(OH)4] KAl(SO4)2 алюмокалиевая CaOCl2 Хлорная известь](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/967195/slide-4.jpg)
















 Устойчивое развитие
Устойчивое развитие Основы химии буровых растворов
Основы химии буровых растворов Вода – самое удивительное вещество на Земле
Вода – самое удивительное вещество на Земле Полимеры
Полимеры Презентация на тему Кристаллическая решетка
Презентация на тему Кристаллическая решетка  Молекулярно-кинетическая теория. Макро- и микропараметры
Молекулярно-кинетическая теория. Макро- и микропараметры Сахароза (С12Н22О11)
Сахароза (С12Н22О11) Презентация на тему Войди в природу другом
Презентация на тему Войди в природу другом  Небезпечні речовини
Небезпечні речовини Строение электронных оболочек атомов элементов
Строение электронных оболочек атомов элементов Условия преобразования органических веществ
Условия преобразования органических веществ Изучаем химию с Агатой Кристи
Изучаем химию с Агатой Кристи Сера
Сера Химические свойства воды
Химические свойства воды Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Изомерия
Изомерия Эмульсии
Эмульсии Очистка рабочих электродов
Очистка рабочих электродов Ксантановая камедь
Ксантановая камедь Презентация на тему Химия в сельском хозяйстве
Презентация на тему Химия в сельском хозяйстве  Полимеры и пластмассы
Полимеры и пластмассы Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Алмазы
Алмазы Электролиз
Электролиз Периодический закон и периодическая система химических элементов. 11 класс
Периодический закон и периодическая система химических элементов. 11 класс Молекулярная струйная печать
Молекулярная струйная печать Презентация на тему Что такое нано?
Презентация на тему Что такое нано?  Пространственное строение органических соединений
Пространственное строение органических соединений