Содержание
- 2. Содержание Из истории открытия Положение азота в Периодической системе Строение атома азота Образование молекулы азота Физические
- 3. N - Nitrogenium Открыт Д.Резерфордом в 1772 г Назван А.Лавуазье в 1887 г
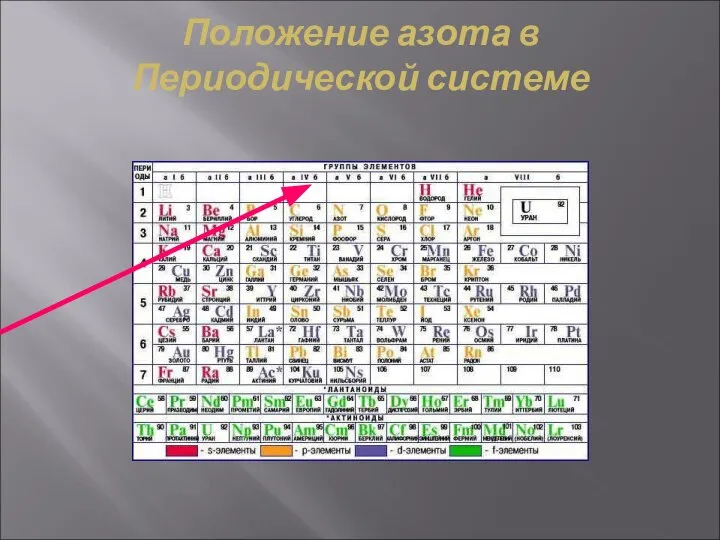
- 4. Положение азота в Периодической системе
- 5. Строение атома азота N Азот 14,0067 2 5 7 2s22p3 N 7N II период V группа
- 6. N 2s 2p Строение молекулы азота N2 px pz py N + N N N :
- 7. Физические свойства азота Бесцветный газ Не имеет запаха Не поддерживает дыхания Мало растворим в воде (в
- 8. Химические свойства азота F – F O = O N ≡ N 151 кДж/моль 494 кДж/моль
- 9. Получение азота Применение азота Т кип (О2) = - 183 °C, Т кип (N2)= - 196
- 11. Скачать презентацию







 Бензол
Бензол Физико-химические свойства растворов ВМС
Физико-химические свойства растворов ВМС Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Этиленовые углеводороды
Этиленовые углеводороды Презентация на тему Химический элемент - водород
Презентация на тему Химический элемент - водород  Ковалентная химическая связь
Ковалентная химическая связь Презентация на тему Коррозия металлов
Презентация на тему Коррозия металлов  Алкины. Ацетилен
Алкины. Ацетилен История создания периодической таблицы
История создания периодической таблицы Сложные вещества кислоты
Сложные вещества кислоты Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12
Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12 Исследование кокаина методом ГХ-МС
Исследование кокаина методом ГХ-МС Выбраковка результатов химического анализа
Выбраковка результатов химического анализа Reactivi444
Reactivi444 Химическое равновесие
Химическое равновесие Nanotechnology (theoretical part)
Nanotechnology (theoretical part) Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Презентация на тему Роль химии в жизни человека
Презентация на тему Роль химии в жизни человека  Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Галогены
Галогены Катализ в нефтепереработке
Катализ в нефтепереработке Циклоалканы
Циклоалканы Алюминий и его свойства
Алюминий и его свойства Химическая связь 11 класс - Презентация_
Химическая связь 11 класс - Презентация_ Физическая химия. Лекция 1. Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической
Физическая химия. Лекция 1. Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической Алканы
Алканы Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Ионообменная хроматография
Ионообменная хроматография