Содержание
- 2. Сьогодні на уроці ви дізнаєтесь: Поняття ненасичені віглеводні. Характеристика потрійного зв’язку. Ізомерія і номенклатура алкінів. Фізичні
- 3. Поняття про алкіни Алкіни – вуглеводні, що містять в молекулі один або кілька потрійних зв’язків і
- 4. Характеристика потрійного зв’язку Вид гібридизації – sp Валентний кут – 180° Довжина зв’язку С = С
- 5. Схема утворення sp -гібридних орбіталей
- 6. Схема утворення sp -гібридних орбіталей
- 7. Гомологічний ряд алкінів C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 C8H14 Етин Пропин Бутин Пентин Гексин Гептин
- 8. Ізомерія алкінів Структурна ізомерія 1. Ізомерія положення потрійного зв’язку (починаючи з С4Н6): СН ≡С−СН2−СН3 СН3−С≡С−СН3 бутин-1
- 9. Виконайте вправу: Назвіть речовину. Складіть до неї три ізомери різних видів ізомерії. Назвіть ізомери.
- 10. Фізичні властивості Температура кипіння і плавлення алкінів, так як і алкенів, закономірно підвищується із зростанням молекулярної
- 11. Ацетилен добувають в промисловості двома способами: 1. Термічний крекінг метану: 1500°С 2СН4 ⎯⎯→ С2Н2 + 3Н2
- 12. Хімічні властивості алкінів Хімічні властивості ацетилену і його гомологів визначаються наявністю в їх молекулах потрійного зв’язку.
- 13. Реакції приєднання 1. Галогенування Знебарвлення бромної води є якісною реакцією на всі ненасичені вуглеводні.
- 14. 2. Гідрогалогенування. 3. Гідрування. 4. Гідратація. HgSO4 Н−C≡C−H + H2O ⎯→ [H−C=C−H] ⎯→ CH3−C−H ⏐ ⏐
- 15. Окиснення Ацетилен і його гомологи окиснюються перманганатом калію з розщепленням потрійного зв’язку і утворенням карбонових кислот.
- 16. Горіння ацетилену При спалюванні (повному окисненні) ацетилену виділяється велика кількість тепла: HC≡CH + 2О2 ⎯→ 2СО2
- 17. Реакції заміщення При взаємодії ацетилену (або R−C≡C−H) з аміачним розчином оксиду срібла утворюються осади нерозчинних ацетиленідів:
- 18. Реакція полімеризації 1. Димеризація під дією водного розчину CuCl2 і NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH
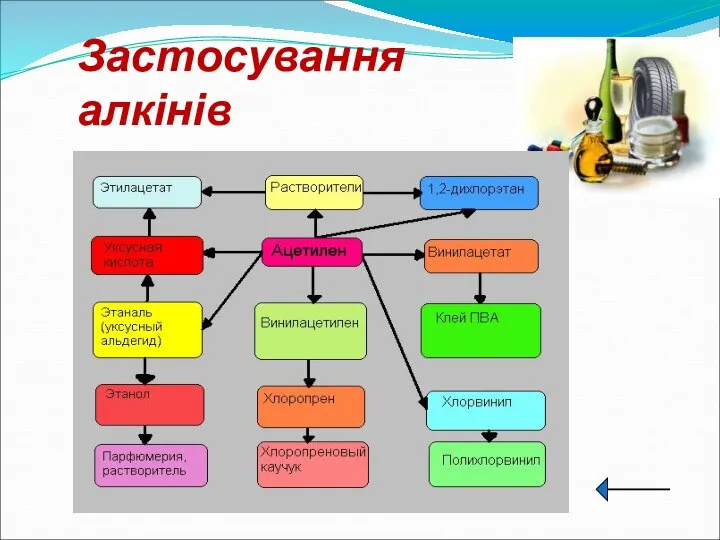
- 19. Застосування алкінів
- 21. Скачать презентацию












![2. Гідрогалогенування. 3. Гідрування. 4. Гідратація. HgSO4 Н−C≡C−H + H2O ⎯→ [H−C=C−H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/989531/slide-13.jpg)




 Эксперимент Осадки и растворы
Эксперимент Осадки и растворы Задачи. Химические элементы
Задачи. Химические элементы Основные понятия химии
Основные понятия химии Газообразные (газ)
Газообразные (газ) Презентация по Химии "Алканолы"
Презентация по Химии "Алканолы"  Простые вещества – неметаллы. Аллотропия
Простые вещества – неметаллы. Аллотропия Урок-путешествие по теме «Первоначальные химические понятия»
Урок-путешествие по теме «Первоначальные химические понятия» Электронная структура атомов
Электронная структура атомов Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР
Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР Валентность. Нахождение химической формулы вещества по валентности
Валентность. Нахождение химической формулы вещества по валентности Углеводороды. Предельные (насыщенные) углеводороды
Углеводороды. Предельные (насыщенные) углеводороды Химическая связь. Лекция №3
Химическая связь. Лекция №3 Ароматические кислородсодержащие соединения
Ароматические кислородсодержащие соединения Титан. История открытия титана
Титан. История открытия титана Коррозия металла
Коррозия металла Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Кислород
Кислород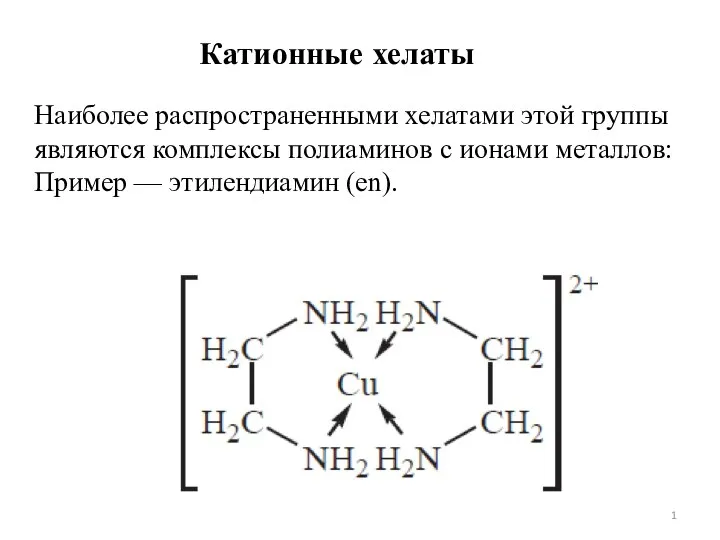 Хелатный эффект. Лекция 7
Хелатный эффект. Лекция 7 Растворы. Растворение веществ. 8 класс
Растворы. Растворение веществ. 8 класс Биогенный элемент. Кобальт (Со)
Биогенный элемент. Кобальт (Со) Конспект по химии
Конспект по химии Скорость химической реакции
Скорость химической реакции Соединения щелочных металлов
Соединения щелочных металлов Металлическая химическая связь
Металлическая химическая связь Химический диктант по органической химии. 9 класс
Химический диктант по органической химии. 9 класс Основания
Основания Пластификация пластмасс
Пластификация пластмасс