Содержание
- 2. Для этого необходимо выполнить составить уравнения реакций в молекулярном виде Определить степень окисления элементов В реакциях,
- 3. Составим молекулярные уравнения реакций 2Cu + O2 ? 2CuO CuO + 2HCl ? CuCl2 + H2O
- 4. Определим степень окисления элементов 2Cu0 + O20? 2Cu+2O-2 Cu +2 O-2 + 2H+Cl- ? Cu+2Cl2-1 +
- 5. Степень окисления элементов изменилась только в первой реакции 2Cu0 + O20? 2Cu+2O-2 Определим переход электронов Найдем
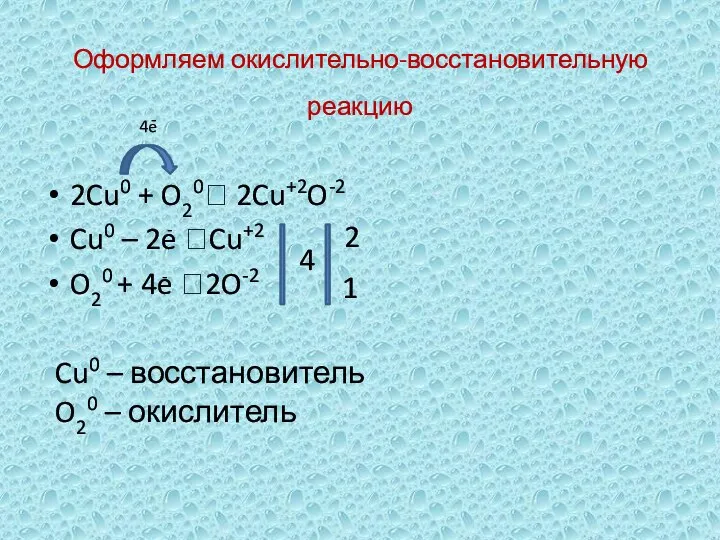
- 6. Оформляем окислительно-восстановительную реакцию 2Cu0 + O20? 2Cu+2O-2 Cu0 – 2e ?Cu+2 O20 + 4e ?2O-2 4
- 7. Составляем полные ионные уравнения CuO + 2H+ + 2Сl - ? Cu+2 + 2Cl - +
- 8. Составляем краткие ионные уравнения CuO + 2H+ ?Cu+2 + H2O Cu+2 + 2OH - ? Cu(OH)2
- 10. Скачать презентацию






 Неметаллы
Неметаллы Искусственные и синтетические полимеры
Искусственные и синтетические полимеры Медь и ее сплавы
Медь и ее сплавы Хлордың қолданылуы
Хлордың қолданылуы Соединения серы. Сернистая и серная кислоты
Соединения серы. Сернистая и серная кислоты Строение вещества
Строение вещества Порядковый номер элемента. Изотопы
Порядковый номер элемента. Изотопы Салқындатқыш агенттер және оларды салқындату әдістері
Салқындатқыш агенттер және оларды салқындату әдістері Виды химической связи
Виды химической связи Презентация на тему Алкины
Презентация на тему Алкины  Олово
Олово Сложные неорганические вещества
Сложные неорганические вещества Синтетические моющие средства (СМС). Наша стирка по-байкальски
Синтетические моющие средства (СМС). Наша стирка по-байкальски Типы кристаллических решеток
Типы кристаллических решеток Алкены
Алкены Химически опасные объекты Аварии, связанные с выбросом АХОВ
Химически опасные объекты Аварии, связанные с выбросом АХОВ Карбоновые кислоты
Карбоновые кислоты Примеры карбоновых кислот
Примеры карбоновых кислот Презентация на тему Нанотехнологии и Наноматериалы
Презентация на тему Нанотехнологии и Наноматериалы  Дисперсные системы. Тест
Дисперсные системы. Тест Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Щелочные металлы
Щелочные металлы Олово и оловоорганические соединения, их свойства и применение
Олово и оловоорганические соединения, их свойства и применение Значение химии в медицине
Значение химии в медицине Презентация на тему Витамины. Урок химии 10 класс
Презентация на тему Витамины. Урок химии 10 класс  Производство аммиака
Производство аммиака кинетика (1)
кинетика (1) Коррозия металлов. Лекция №8
Коррозия металлов. Лекция №8