Содержание
- 2. Как повысить скорость химической реакции: А2(г)+ 3В2(г) = 2АВ3 в 81 раз?
- 3. Скорость химических реакций - 2
- 4. Задачи урока: 1) повторение понятий «скорость химических реакций», «факторы, оказывающие влияние на скорость химических реакций», 2)
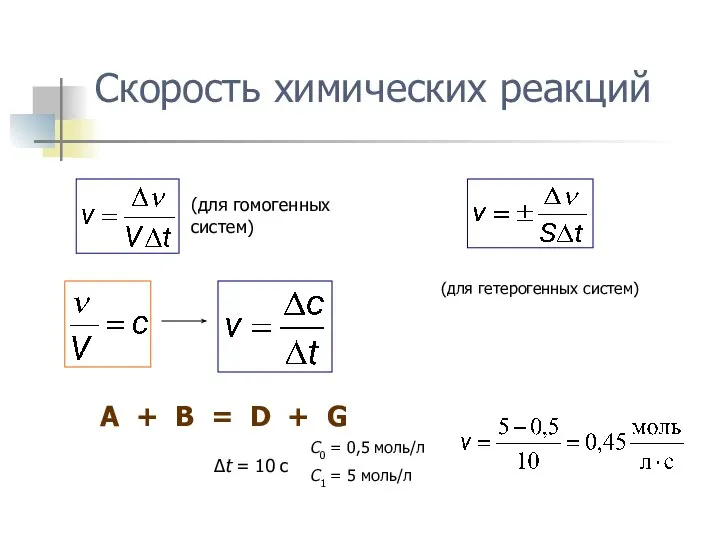
- 5. Скорость химических реакций (для гомогенных систем) A + B = D + G C0 = 0,5
- 6. Факторы, от которых зависит скорость реакции Природа реагирующих веществ Концентрация веществ в системе (давление в газовой
- 7. Закон действующих масс A + B → D + F v = Като Гульдберг (1836-1902) Петер
- 8. Закон действующих масс A + B → D + F v = k · c (A)
- 9. Влияние температуры Правило Вант-Гоффа - температурный коэффициент Вант-Гоффа v = Якоб Вант-Гофф (1852-1911)
- 10. Влияние температуры Правило Вант-Гоффа При нагревании системы на 10 ˚С скорость реакции возрастает в 2-4 раза
- 11. Катализ ввел термин «катализ» в 1835 г. Катализатор – вещество, изменяющее скорость реакции, участвует в промежуточных
- 12. Катализ Йенс Якоб Берцелиус ввел термин «катализ» в 1835 г. Катализатор – вещество, изменяющее скорость реакции,
- 13. Теперь к вопросам ЕГЭ!
- 14. A20-2012 Скорость гомогенной химической реакции пропорциональна изменению: 1)количества вещества в единице объема 2) массы вещества в
- 15. A20-2012 В системе А + В =АВ концентрация вещества А по истечении 5 сек изменилась от
- 16. A20-2012 Какой из факторов не оказывает влияния на скорость химической реакции в растворах? 1) концентрация вещества
- 17. A20-2012 На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния 1) концентрация
- 18. A20-2012 Для увеличения скорости химической реакции Mg (тв.) + 2H+ = Mg2+ + H2(г.) необходимо 1)
- 19. A20-2012 C наибольшей скоростью при обычных условиях протекает реакция 1) 2Ba + O2 = 2BaO 2)
- 20. A20-2012 Для увеличения скорости реакции 2CO + O2 = 2CO2 + Q необходимо 1) повысить температуру
- 21. A20-2012 Быстрее при комнатной температуре будет протекать реакция между 10%- ным раствором соляной кислоты и 1)
- 22. A20-2012 С наименьшей скоростью при обычных условиях протекает реакция: 1) Fe + O2 2) CaCO3 +
- 23. A20-2012 При увеличении температуры от 10 до 30 0С скорость реакции, температурный коэффициент которой равен 3,
- 24. A20-2012 При увеличении концентрации СО в 2 раза в системе: 2СО + О2 = 2 СО2,
- 25. A20-2012 При увеличении давления в системе N2 + 3H2 = 2NH3 в 3 раза скорость прямой
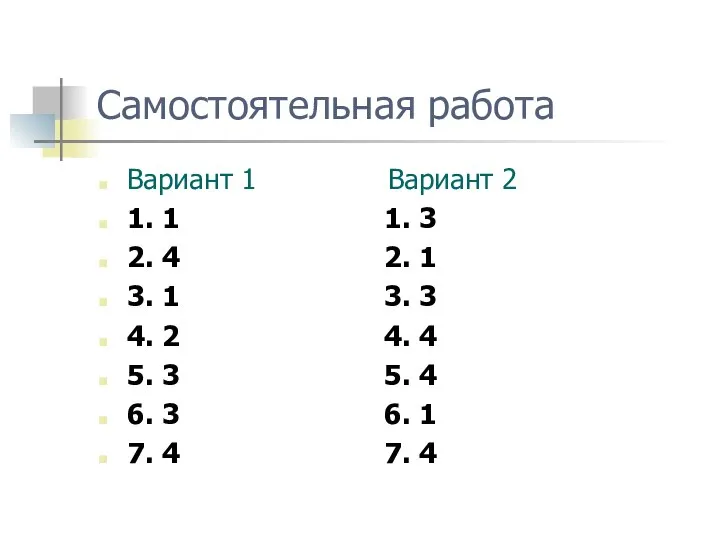
- 26. Самостоятельная работа по теме «Скорость химической реакции» по материалам и в форме ЕГЭ
- 27. Самостоятельная работа Вариант 1 Вариант 2 1. 1 1. 3 2. 4 2. 1 3. 1
- 28. Самостоятельная работа Вариант 1 1. С наибольшей скоростью с водородом реагирует 1. CI2 2. N2 3.
- 29. Самостоятельная работа Вариант 1 3. Увеличение скорости разложения бертолетовой соли KCIO3 в большей степени зависит от
- 30. Самостоятельная работа Вариант 1 5. Растворение магния в соляной кислоте будет замедляться при 1. увеличении концентрации
- 31. Самостоятельная работа Вариант 1 7. Скорость реакции 2H 2S(г)+3O 2(г)=2H 2O(ж)+2SO 2(г) при увеличении давления в
- 32. Самостоятельная работа Вариант 2 1. С наибольшей скоростью с водой реагирует 1. Pb 2. Mg 3.
- 33. Самостоятельная работа Вариант 2 3. Скорость реакции S+O2=SO2 уменьшается при 1. нагревании 2. увеличении давления 3.
- 34. Самостоятельная работа Вариант 2 5. С наименьшей скоростью происходит реакция между цинком и 1. HCI(20%-ный p-p)
- 35. Самостоятельная работа Вариант 2 7. Скорость реакции 2H 2S(г)+3O 2(г)=2H 2O(ж)+2SO 2(г) при уменьшении давления в
- 36. Факторы, от которых зависит скорость реакции Природа реагирующих веществ Концентрация веществ в системе (давление в газовой
- 37. Как повысить скорость химической реакции: А2(г)+ 3В2(г) = 2АВ3 в 81 раз?
- 38. Как повысить скорость химической реакции: А2(г)+ 3В2(г) = 2АВ3 в 81 раз? А) повысить температуру на
- 39. Задачи урока: 1) повторение понятий «скорость химических реакций», «факторы, оказывающие влияние на скорость химических реакций», 2)
- 40. Скорость химических реакций
- 42. Скачать презентацию




































 Презентация на тему Жизнь Д.И.Менделеева
Презентация на тему Жизнь Д.И.Менделеева  Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Природные источники углеводородов
Природные источники углеводородов Углерод и его соединения
Углерод и его соединения ЭОР в преподавании химии
ЭОР в преподавании химии Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение Химические соединения в живых организмах. Неорганические вещества
Химические соединения в живых организмах. Неорганические вещества Необратимый (совместный) гидролиз
Необратимый (совместный) гидролиз Презентация на тему Массовая доля вещества в растворе
Презентация на тему Массовая доля вещества в растворе  Особо чистые вещества. Занятие 12
Особо чистые вещества. Занятие 12 Подготовка учащихся к государственной (итоговой) аттестации по химии
Подготовка учащихся к государственной (итоговой) аттестации по химии Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Фосфор. Элемент жизни и мысли
Фосфор. Элемент жизни и мысли Спирты
Спирты Открытый урок химии. Типы химических реакций
Открытый урок химии. Типы химических реакций Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции Реакции обмена
Реакции обмена Железо
Железо Введение в метаболизм
Введение в метаболизм Primenenie_kauchukov
Primenenie_kauchukov Нефть. Способы переработки нефти
Нефть. Способы переработки нефти Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535
Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535 Углеводы. Полисахариды. Важнейшие представители
Углеводы. Полисахариды. Важнейшие представители Загадочный фосфор
Загадочный фосфор Химические реакции. Подготовка к контрольной работе №2
Химические реакции. Подготовка к контрольной работе №2 Винилпиридиновые каучуки
Винилпиридиновые каучуки Алканы
Алканы Строение вещества
Строение вещества