Слайд 2 Стехиометрия –раздел химии, в котором рассматриваются массовые или объемные отношения между

реагирующими веществами.
Термин «стехиометрия» ввел в 1792 г. И. Рихтер, образовав его из двух греческих слов: «стехион», означающего «элементный состав», и «метрейн», означающего «измерять».
Слайд 3 Значение стехиометрии
Стехиометрия имеет фундаментальное значение в современной химии. Она

является основой количественного химического анализа. В химической промышленности знание стехиометрии необходимо для вычисления выхода продуктов реакции и эффективности химических реакций. В аэрокосмической и транспортной промышленности стехиометрические методы необходимы для вычисления расхода горючего.
Слайд 4Каждое вещество имеет свою химическую формулу
Стехиометрические законы
1.Закон постоянства состава (Ж.Пруст

1808 г.) «Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества»
Слайд 52. Закон сохранения массы: « Масса реагентов равна массе продуктов реакции.»
С законом

сохранения массы веществ тесно связан закон сохранения энергии: энергия не создается из ничего и не теряется бесследно.
Е= mc2
Слайд 6Количество вещества –физическая величина, характеризующая количество однотипных структурных единиц( атомы, молекулы, ионы

и т.д.)
Моль- количество вещества , содержащее столько структурных единиц этого вещества, сколько атомов содержит порция углерода С массой 12г ( 0.012кг)
Число атомов в порции углерода -12 массой 12г равно 6.02*10 23
Слайд 7М= m/n, где М-молярная масса, m- масса вещества,n- количество вещества
(m=М *n ;

n= m/М )
Задача: Вычислите количество вещества углекислого газа массой 8,8г
Слайд 8Решение:
1.М (СО2) = 44г/ моль
2. Определяем количество СО2
n (CO2) =

m(CO2) = 8,8 г = 0,2 моль
M(CO2) 44г/моль
Слайд 9
3. Закон Авогадро. Закон объемных отношений
( или химический закон Гей-Люссака): объемы вступающих

в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа
Слайд 10Первое следствие из закона Авогадро
Одинаковое число молекул различных газов при одинаковых условиях

занимает одинаковый объем:
Vm – молярный объем (22,4л)
V=Vm*n V=Vm * m
M
Слайд 11Второе следствие из закона Авогадро
Плотность любого вещества ρ - это отношение массы

этого вещества m к его объемуV
ρ= m/V
Задача: Чему равна относительная плотность углекислого газа СО2 по : а) водороду; б) воздуху?










 10В Циклоалканы (1)
10В Циклоалканы (1)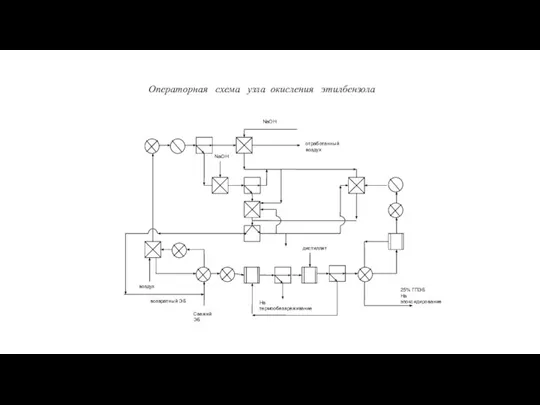 Эпоксидирование олефинов (халкон-процесс)
Эпоксидирование олефинов (халкон-процесс) Свойства воды
Свойства воды Актиний. Нахождение в природе
Актиний. Нахождение в природе Окислительно – восстановительные реакции (урок химии в 11 классе)
Окислительно – восстановительные реакции (урок химии в 11 классе) Растворы. 11 класс
Растворы. 11 класс Виды оксидов азота
Виды оксидов азота Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Дефекты в кристаллах
Дефекты в кристаллах Көмірдің оптикалық қасиеттері
Көмірдің оптикалық қасиеттері Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека  анлекция 3
анлекция 3 Хлор. Нахождение в природе
Хлор. Нахождение в природе Общая химия, понятия
Общая химия, понятия Полімер поліетилен
Полімер поліетилен Презентация Щелочные металлы
Презентация Щелочные металлы Основания и их свойства
Основания и их свойства Химический эквивалент. Лекция 2
Химический эквивалент. Лекция 2 Практическое занятие: Решение задач. Классификация химических реакций
Практическое занятие: Решение задач. Классификация химических реакций Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Кремний и 4 группа. 9 класс
Кремний и 4 группа. 9 класс Знаки химических элементов
Знаки химических элементов Разбор заданий на амины
Разбор заданий на амины Геохимические процессы в литосфере Земли и геобаротермометрия
Геохимические процессы в литосфере Земли и геобаротермометрия Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора
Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора Электролиз
Электролиз Презентация на тему Белки
Презентация на тему Белки  Кислоты с металлами
Кислоты с металлами