Содержание
- 2. Понятие атом Атом (греч. «atomos» – неделимый) ввел Демокрит. Атомы выступают в роли первоначала. Они неделимы,
- 3. Атомно-молекулярное учение Возродил атомистическую теорию английский физик и химик Джон Дальтон. Атомы одного элемента имеют одинаковые
- 4. Атом делим!!! Атом делим, как доказали следующие экспериментальные открытия, сделанные в науке на рубеже конца 19-начала
- 5. Катодные лучи В 1879 году Крукс открыл катодные лучи, представляющие собой поток электронов в вакуумной трубке,
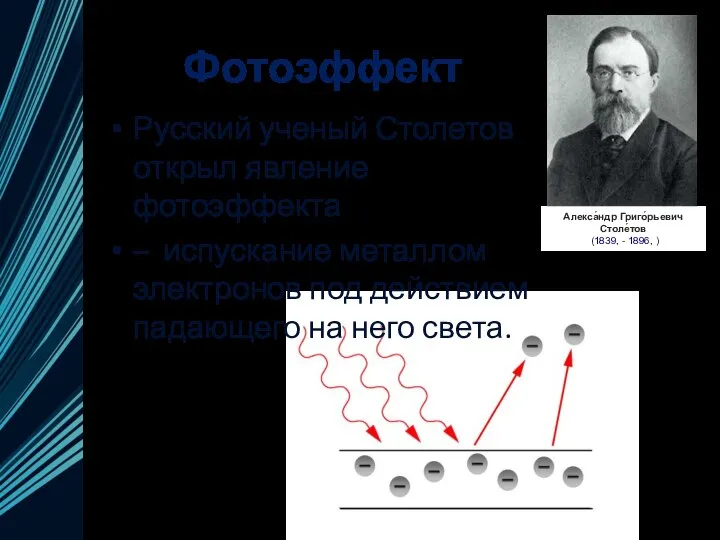
- 6. Фотоэффект Русский ученый Столетов открыл явление фотоэффекта – испускание металлом электронов под действием падающего на него
- 7. Рентгеновское излучение Значимым стало открытие Рентгеном «Х»-лучей. Эти лучи представляют собой электромагнитное излучение подобное свету с
- 8. Радиоактивность Большой вклад в развитие представлений об элементарных частицах внесли Радиоактивность – это явление самопроизвольного превращения
- 9. Электролиз Вспомните, что это? Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых
- 10. Модели строения атома Модель Томсона – «пудинговая модель» 1904 год
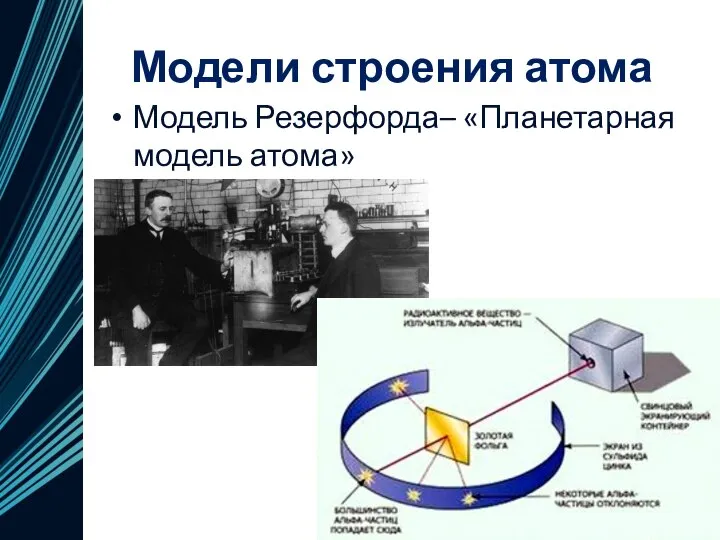
- 11. Модели строения атома Модель Резерфорда– «Планетарная модель атома»
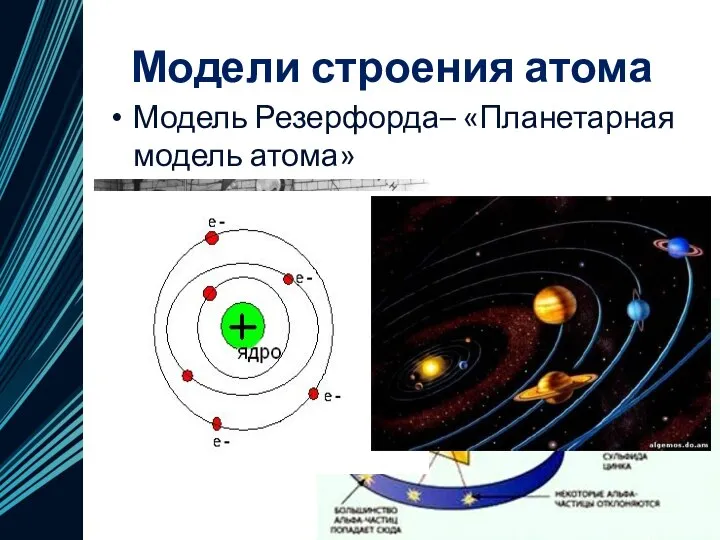
- 12. Модели строения атома Модель Резерфорда– «Планетарная модель атома»
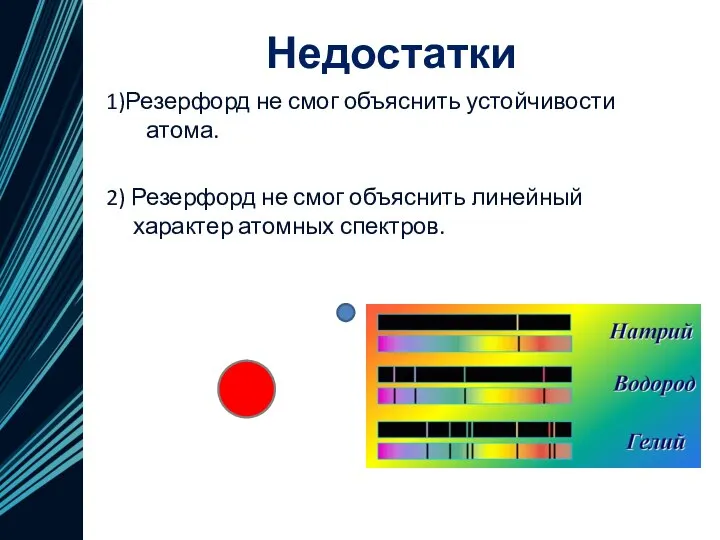
- 13. Недостатки 1)Резерфорд не смог объяснить устойчивости атома. 2) Резерфорд не смог объяснить линейный характер атомных спектров.
- 14. Квантовая модель 1913 год Основные положения он сформулировал в виде постулатов: I. Электрон может вращаться вокруг
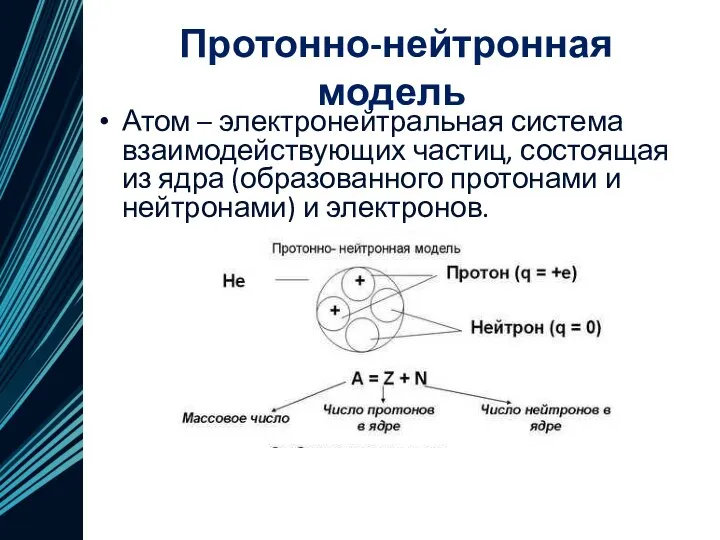
- 15. Протонно-нейтронная модель В 1932 году Иваненко предложил протонно-нейтронную модель ядра. Эту теорию развил Гейзенберг. Эта модель
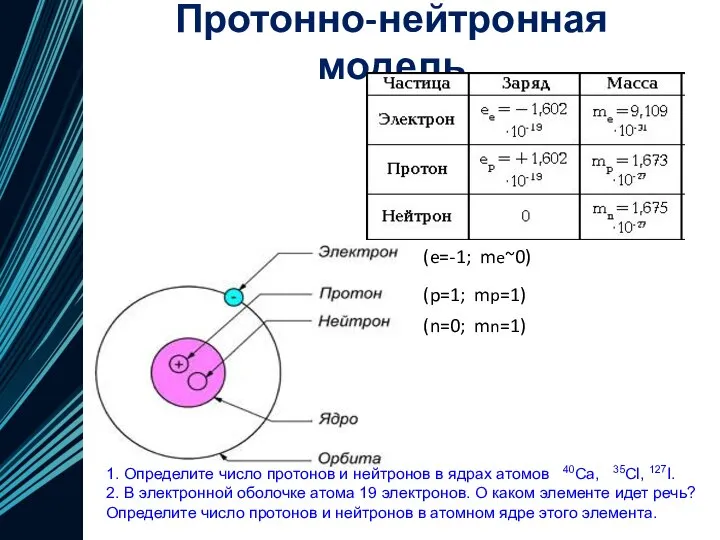
- 16. Протонно-нейтронная модель Атом – электронейтральная система взаимодействующих частиц, состоящая из ядра (образованного протонами и нейтронами) и
- 17. Протонно-нейтронная модель 1. Определите число протонов и нейтронов в ядрах атомов 40Ca, 35Cl, 127I. 2. В
- 18. Изотопы - Это разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд атомного ядра(одинаковое
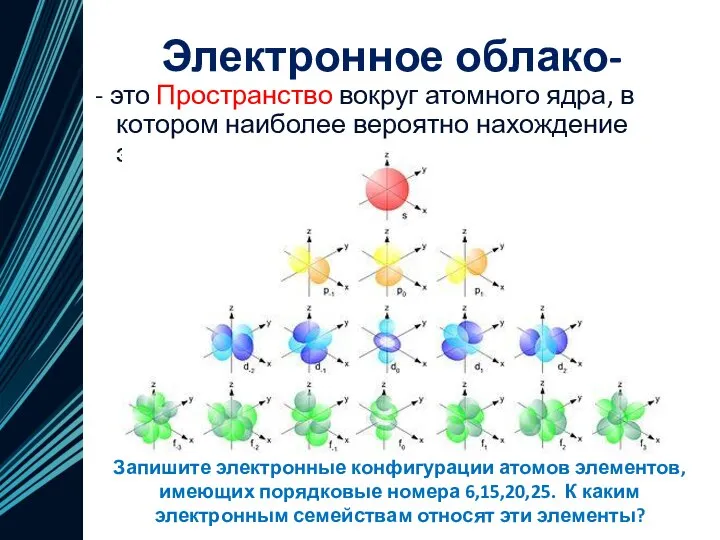
- 19. Электронное облако- - это Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона. Запишите электронные
- 20. Рефлексия Тема сегодняшнего урока была интересна, все было понятно - Мне было интересно, но не все
- 21. Д/з п.1, в.3,6,7,10
- 22. Источники Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2013. Габриелян
- 24. Скачать презентацию














 Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева
Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева Скорость химической реакции
Скорость химической реакции Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю Физический этап развития периодического закона
Физический этап развития периодического закона Презентация по Химии "Токсическое действие неорганических веществ"
Презентация по Химии "Токсическое действие неорганических веществ"  Презентация на тему Спирты 10 класс
Презентация на тему Спирты 10 класс  Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Консистентные смазки для легковых автомобилей
Консистентные смазки для легковых автомобилей Предельные одноосновные карбоновые кислоты. Сложные эфиры
Предельные одноосновные карбоновые кислоты. Сложные эфиры Основы химической термодинамики и термохимии
Основы химической термодинамики и термохимии Презентация на тему Жиры, их строение и свойства
Презентация на тему Жиры, их строение и свойства  Алмазы
Алмазы Презентация на тему Оксид кремния
Презентация на тему Оксид кремния  Получение металлов
Получение металлов знаки химических элементов,относительная атомная масса
знаки химических элементов,относительная атомная масса Степени окисления и формулы веществ
Степени окисления и формулы веществ Молярный объем газов. Закон Авогадро
Молярный объем газов. Закон Авогадро Органическая химия. Теория строения органических соединений
Органическая химия. Теория строения органических соединений Цезій
Цезій Презентация на тему Натуральные волокна
Презентация на тему Натуральные волокна  Дисперсные системы
Дисперсные системы Бензол. Cвойства, реакции, применение
Бензол. Cвойства, реакции, применение Создание полупроводниковых структур методами химического осаждения из истинных и коллоидных растворов
Создание полупроводниковых структур методами химического осаждения из истинных и коллоидных растворов Презентация на тему Стекло. История открытия, получение, применение
Презентация на тему Стекло. История открытия, получение, применение  Физико-химические методы получения порошков металлов
Физико-химические методы получения порошков металлов Красители для волос. Первая группа
Красители для волос. Первая группа Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Основи масообміну
Основи масообміну