Содержание
- 2. Электронная оболочка – совокупность всех электронов в атоме окружающих ядро Каждый электрон имеет свою траекторию движения
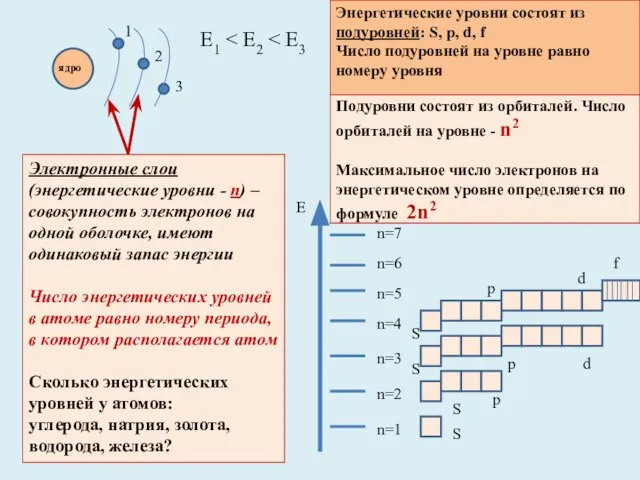
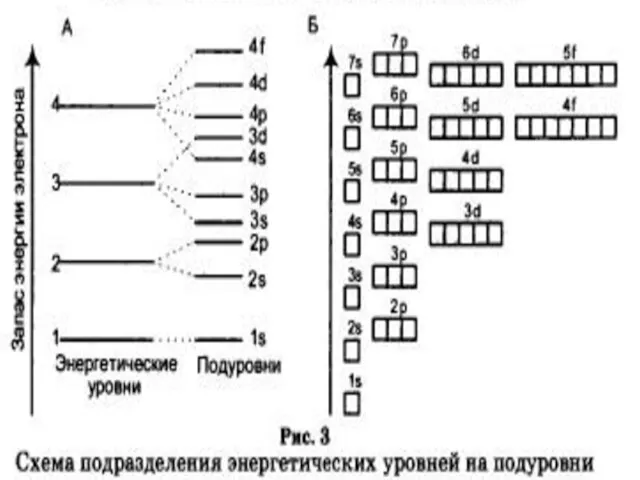
- 3. Подуровни состоят из орбиталей. Число орбиталей на уровне - n2 Максимальное число электронов на энергетическом уровне
- 4. Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной устойчивостью и стабильностью Энергетические уровни,
- 5. ЗАПОМНИТЕ!!!! Электроны, расположенные на последней электронной оболочке, называются внешними Число внешних электронов для химических элементов главных
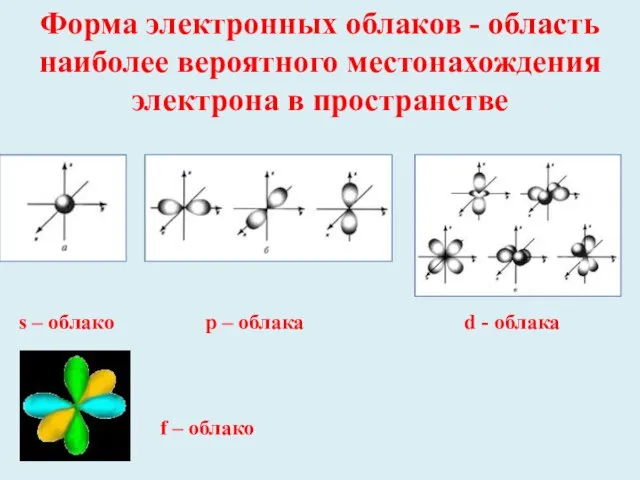
- 6. Форма электронных облаков - область наиболее вероятного местонахождения электрона в пространстве s – облако р –
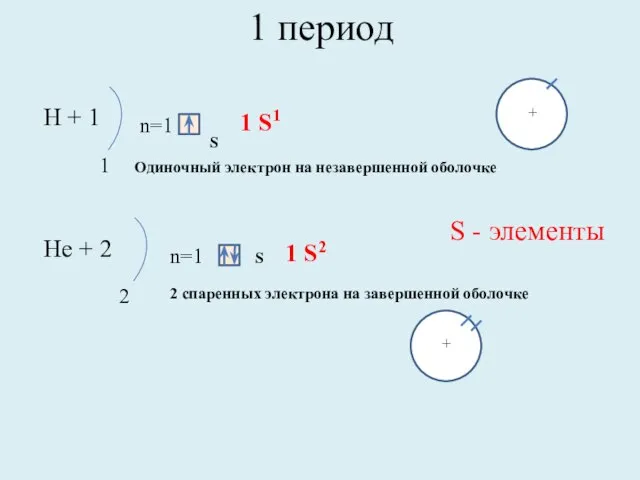
- 7. 1 период Н + 1 1 n=1 S 1 S1 Нe + 2 2 n=1 S
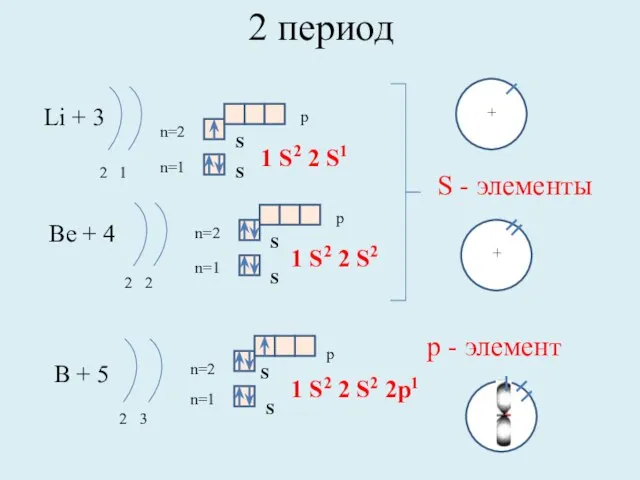
- 8. 2 период Li + 3 2 1 n=1 n=2 1 S2 2 S1 Be + 4
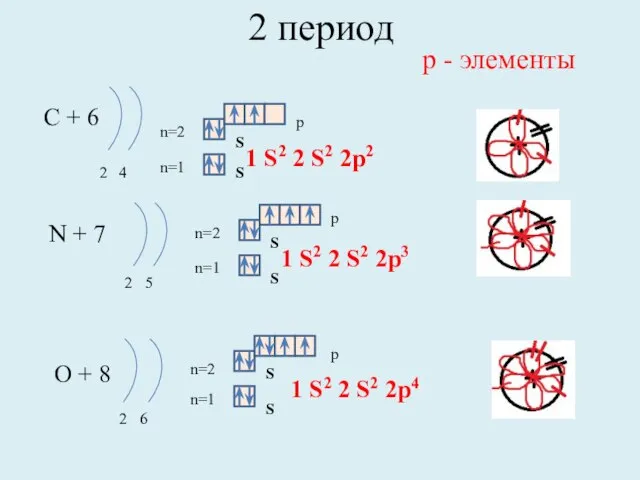
- 9. 2 период С + 6 2 4 n=1 n=2 N + 7 2 5 n=1 n=2
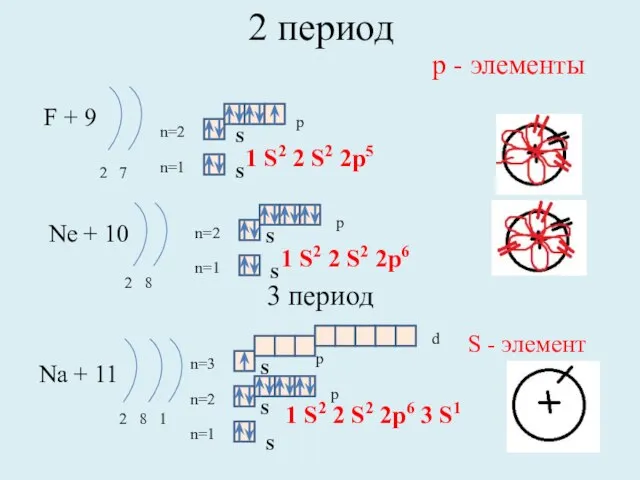
- 10. 2 период F + 9 2 7 n=1 n=2 Ne + 10 2 8 n=1 n=2
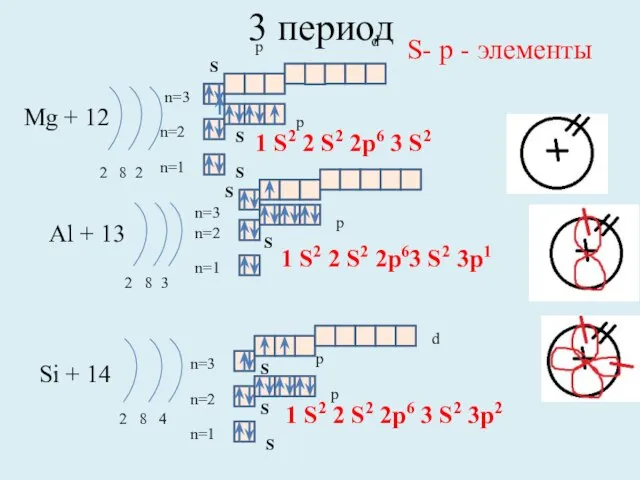
- 11. 3 период Mg + 12 2 8 2 n=1 n=2 Al + 13 2 8 3
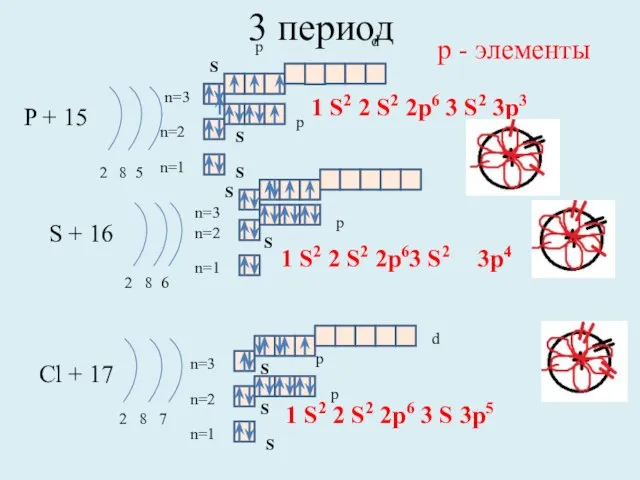
- 12. 3 период P + 15 2 8 5 n=1 n=2 S + 16 2 8 6
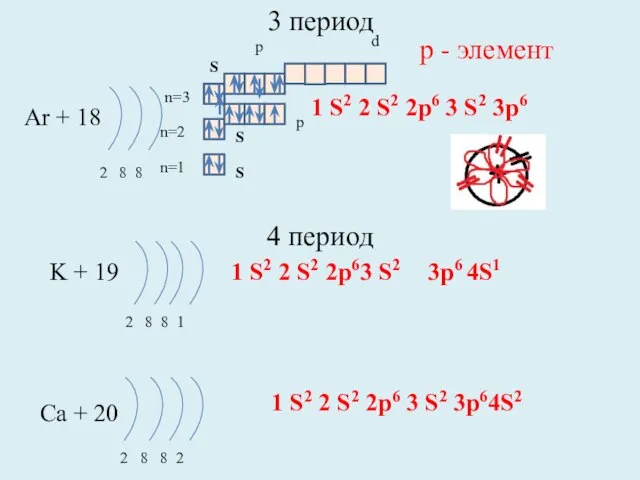
- 13. 3 период Ar + 18 2 8 8 n=1 n=2 K + 19 2 8 8
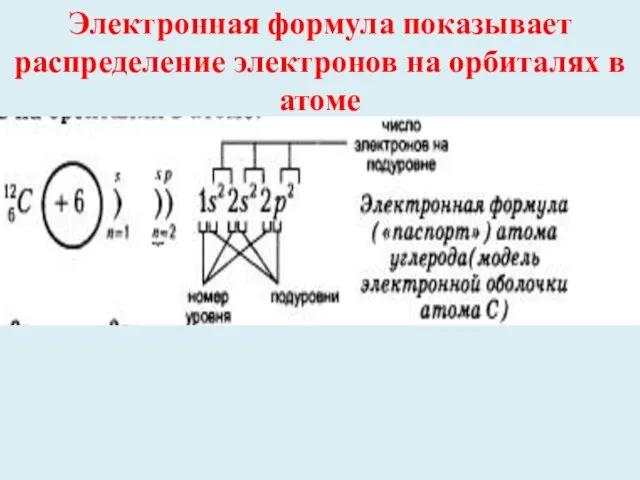
- 15. Электронная формула показывает распределение электронов на орбиталях в атоме
- 17. Скачать презентацию



 Окисление этанола оксидом меди
Окисление этанола оксидом меди Классификация органических соединений. 10 класс
Классификация органических соединений. 10 класс Металлы и их соединения
Металлы и их соединения Сложные эфиры. Жиры
Сложные эфиры. Жиры Сложные неорганические вещества
Сложные неорганические вещества Общая характеристика металлов
Общая характеристика металлов Биопластик на основе лигнина
Биопластик на основе лигнина Основные положения теории строения органических соединений А.М. Бутлерова
Основные положения теории строения органических соединений А.М. Бутлерова Способы выражения концентраций растворов
Способы выражения концентраций растворов Углерод
Углерод Решение задач. Подготовка к контрольной работе по химии
Решение задач. Подготовка к контрольной работе по химии Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Карбоновые кислоты
Карбоновые кислоты khim
khim Кристаллическое состояние полимеров
Кристаллическое состояние полимеров Химические свойства алканов
Химические свойства алканов Минералы и горные породы
Минералы и горные породы Ионная хроматография
Ионная хроматография Презентация на тему Таблица Менделеева внутри нас
Презентация на тему Таблица Менделеева внутри нас  Нуклеин қышқылдары
Нуклеин қышқылдары Йод. Положение в периодической системе
Йод. Положение в периодической системе Описание молекул
Описание молекул НХ 6 Растворы Коллигативные свойства
НХ 6 Растворы Коллигативные свойства Ионные двигатели
Ионные двигатели Теория строения органических соединений
Теория строения органических соединений Химическая связь
Химическая связь Теплофизические свойства полимеров. Методы определения теплостойкости полимеров
Теплофизические свойства полимеров. Методы определения теплостойкости полимеров Общие знания по курсу неорганической химии
Общие знания по курсу неорганической химии