Содержание
Слайд 2Ковалентная связь
Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием пары валентных (находящихся
Ковалентная связь
Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием пары валентных (находящихся

на внешней оболочке атома) электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, лишь затем была подтверждена экспериментально.
Как происходит образование ковалентной связи? Для этого потребуется изрядное воображение.
Представьте, что встречаются атомы 2 разных химических элементов (количество атомов неопределенно). Они неметаллы, главная подгруппа, в общем, что доктор прописал. У одного не хватает для завершения электронной оболочки х электронов, второму – у.
Допустим, что х=у. Тогда атом №1 забирает к себе х электронов у атома №2 и довершает свой внешний энергетический уровень. Но дело в том, что атом №2 тоже забирает х электронов, и в итоге между собой скрепляются х+х=2х электронов.
Такой тип называют неполярной ковалентной связью.
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, лишь затем была подтверждена экспериментально.
Как происходит образование ковалентной связи? Для этого потребуется изрядное воображение.
Представьте, что встречаются атомы 2 разных химических элементов (количество атомов неопределенно). Они неметаллы, главная подгруппа, в общем, что доктор прописал. У одного не хватает для завершения электронной оболочки х электронов, второму – у.
Допустим, что х=у. Тогда атом №1 забирает к себе х электронов у атома №2 и довершает свой внешний энергетический уровень. Но дело в том, что атом №2 тоже забирает х электронов, и в итоге между собой скрепляются х+х=2х электронов.
Такой тип называют неполярной ковалентной связью.
Слайд 4А если х не равно у?
Тогда образуется ковалентная полярная связь, она базируется
А если х не равно у?
Тогда образуется ковалентная полярная связь, она базируется

на таком понятии как электроотрицательность (об этом будет рассказано немного позже).
Допустим, что х>у (если х<у, то просто поменяйте их местами). Тогда атомов может быть больше, чем 2. Тогда это значит, что атом №1, у которого х электронов не достаёт до 8, имеет х «вакантных» мест для электронов атома №2, при чём каждый попавший на «вакантное» место электрон атома №2 образует ковалентную связь с каким-нибудь электроном атома №1 (теперь понятно, почему инертные газы не вступают в реакции).
В свою очередь, атомов никто не обязывает быть в таком количестве, чтобы они заполняли все вакантные места.
Далее представлены некоторые случаи х и у, при которых занимаются все «вакантные» места.
При чём подставить элементы нетрудно. К примеру, если х (или у) равны 1, то элемент – Cl. Если 2 – то О. Если 3 – то N, а в случае 4 – С.
Допустим, что х>у (если х<у, то просто поменяйте их местами). Тогда атомов может быть больше, чем 2. Тогда это значит, что атом №1, у которого х электронов не достаёт до 8, имеет х «вакантных» мест для электронов атома №2, при чём каждый попавший на «вакантное» место электрон атома №2 образует ковалентную связь с каким-нибудь электроном атома №1 (теперь понятно, почему инертные газы не вступают в реакции).
В свою очередь, атомов никто не обязывает быть в таком количестве, чтобы они заполняли все вакантные места.
Далее представлены некоторые случаи х и у, при которых занимаются все «вакантные» места.
При чём подставить элементы нетрудно. К примеру, если х (или у) равны 1, то элемент – Cl. Если 2 – то О. Если 3 – то N, а в случае 4 – С.
- Предыдущая
Азот, соединения азотаСледующая -
Цены СССР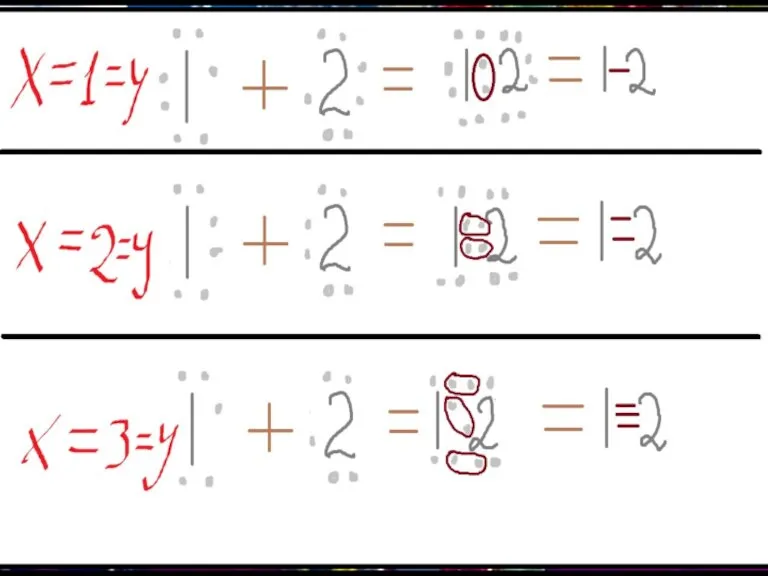

 Основания
Основания Непредельные углеводороды. Алкадиены. Уроки 22-23
Непредельные углеводороды. Алкадиены. Уроки 22-23 Электролиз. Законы Фарадея
Электролиз. Законы Фарадея Значение воды на Земле
Значение воды на Земле Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Химия и автомобиль
Химия и автомобиль Алкены. Строение. Изомерия. Химические свойства. Получение
Алкены. Строение. Изомерия. Химические свойства. Получение Алкены. Этилен C2H4
Алкены. Этилен C2H4 Презентация по Химии "Получение уксусной кислоты и опыты с ней"
Презентация по Химии "Получение уксусной кислоты и опыты с ней"  Техника безопасности при использовании различных видов топлива. Практическая работа № 3
Техника безопасности при использовании различных видов топлива. Практическая работа № 3 Основания. Классификация
Основания. Классификация Приминение серной кислоты в хозяйстве
Приминение серной кислоты в хозяйстве Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства Химические реактивы
Химические реактивы Вода как растворитель. Растворы. Растворимость. 8 класс
Вода как растворитель. Растворы. Растворимость. 8 класс Комплексные соединения
Комплексные соединения Органическая химия
Органическая химия Узоры на молоке. Опыт
Узоры на молоке. Опыт Эфирные масла
Эфирные масла Типы химических реакций
Типы химических реакций Теоретические основы аналитичесой химии. Общие понятия
Теоретические основы аналитичесой химии. Общие понятия Природные источники углеводородов
Природные источники углеводородов Основные типы химических реакций
Основные типы химических реакций Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Cеминар 6 -Алканы-2
Cеминар 6 -Алканы-2 Химические реакции
Химические реакции Презентация на тему Характеристика щелочных металлов 9 класс
Презентация на тему Характеристика щелочных металлов 9 класс  Презентация на тему Уголь
Презентация на тему Уголь