Содержание
- 2. Электролиты Электролит — вещество, раствор которого проводит электрический ток (часто кислоты и щёлочи). Слабые электролиты Распадаются
- 3. Механизм электролитической диссоциации Электролитическая диссоциация - процесс разложения молекул определенного раствора на отрицательные и положительные заряженные
- 4. Степень диссоциации – отношение молекул растворённого вещества, распавшихся на ионы, к общему числу его молекул в
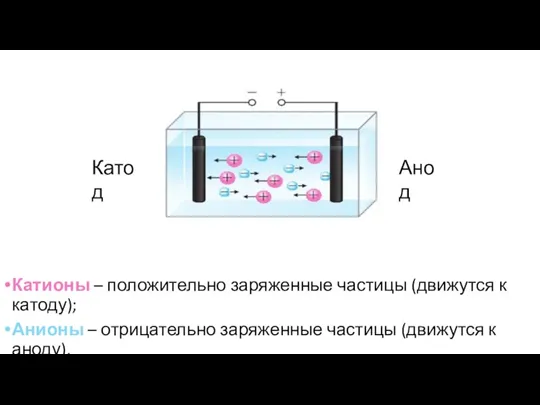
- 5. Катионы – положительно заряженные частицы (движутся к катоду); Анионы – отрицательно заряженные частицы (движутся к аноду).
- 6. Носители заряда в электролите Свободными носителями электрического заряда в электролитах являются «+» и «-» заряженные ионы,
- 7. Электролиз – процесс разложения вещества на составные части, которые оседают на электродах.
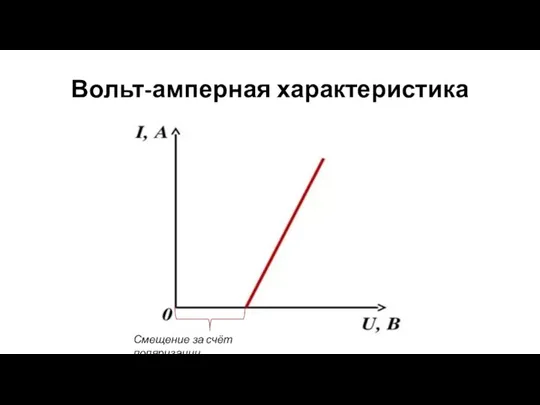
- 8. Вольт-амперная характеристика Смещение за счёт поляризации
- 9. Закон электролиза Фарадея
- 10. Масса вещества, выделившегося на каждом из электродов, прямо пропорциональна силе тока и времени прохождения тока через
- 11. Постоянная Фарадея – заряд, который нужно пропустить через раствор электролита, чтобы выделить на электроде 1 моль
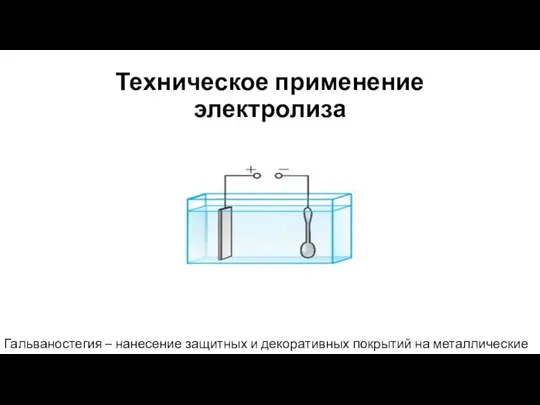
- 12. Техническое применение электролиза Гальваностегия – нанесение защитных и декоративных покрытий на металлические изделия
- 14. Скачать презентацию








 Газ тәрізді диэлектриктер. Пропан
Газ тәрізді диэлектриктер. Пропан Окисники, відновники
Окисники, відновники Основные сведения о металлах и сплавах и их свойства
Основные сведения о металлах и сплавах и их свойства Vzácne plyny
Vzácne plyny Чистые вещества и смеси
Чистые вещества и смеси Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления
Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления Кислород
Кислород Введение. Основные понятия химии
Введение. Основные понятия химии 10_kl_klas-ya
10_kl_klas-ya Влияние давления на скорость химических реакций с участием газов
Влияние давления на скорость химических реакций с участием газов 11_PERMANGANATOMETRIYa_JODOMETRIYa_1
11_PERMANGANATOMETRIYa_JODOMETRIYa_1 Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Счастливый случай
Счастливый случай ОВР
ОВР Основы химической термодинамики и термохимии. Лекция 3
Основы химической термодинамики и термохимии. Лекция 3 Загрязнение почв пестицидами
Загрязнение почв пестицидами Коды Менделеева
Коды Менделеева Химия – это наука о …
Химия – это наука о …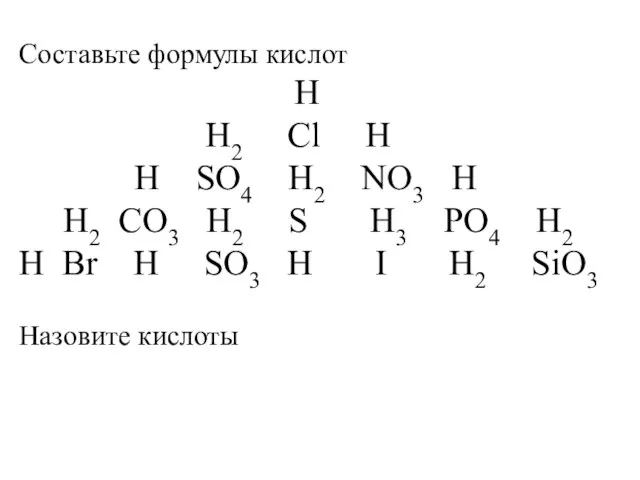 Составьте формулы кислот
Составьте формулы кислот Особенности формирования естественно-научной картины мира на уроках географии и химии
Особенности формирования естественно-научной картины мира на уроках географии и химии Идентификация Бензойной кислоты
Идентификация Бензойной кислоты Сульфиды (2)
Сульфиды (2) Бензол (Арены )
Бензол (Арены ) Непредельные углеводороды ряда этиленовых
Непредельные углеводороды ряда этиленовых Физические и химические свойства металлов
Физические и химические свойства металлов Тривиальные названия веществ, наиболее часто встречаемых в ЕГЭ
Тривиальные названия веществ, наиболее часто встречаемых в ЕГЭ Органическая химия- химия соединений углерода
Органическая химия- химия соединений углерода Сравнительный анализ питьевой бутилированной воды
Сравнительный анализ питьевой бутилированной воды