Содержание
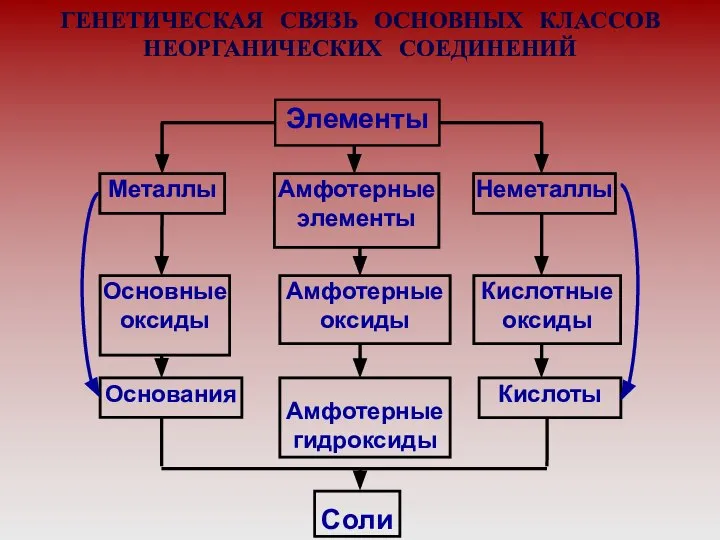
- 2. ГЕНЕТИЧЕСКАЯ СВЯЗЬ ОСНОВНЫХ КЛАССОВ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Элементы Амфотерные элементы Амфотерные оксиды Амфотерные гидроксиды Металлы Основные оксиды
- 3. Химические свойства оксидов, оснований, кислот и солей
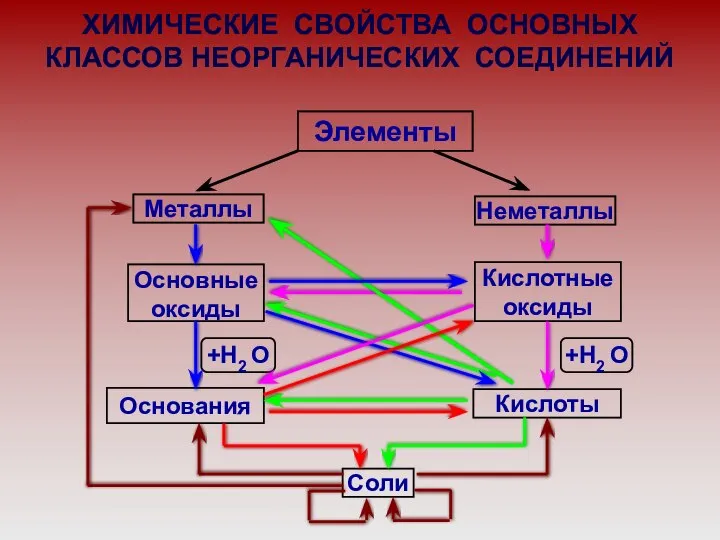
- 4. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ КЛАССОВ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Элементы Металлы Неметаллы Основные оксиды Кислотные оксиды Кислоты Основания +Н2
- 6. Основные оксиды – это сложные вещества, состоящие из металла и кислорода, которым соответствуют основания
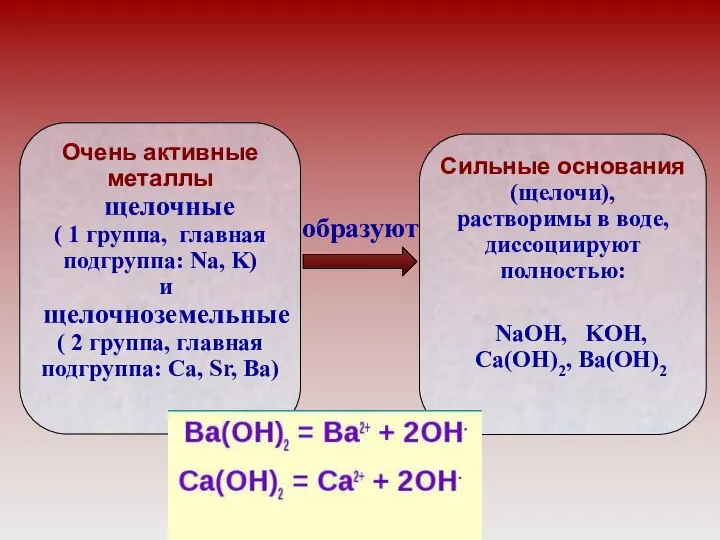
- 7. Оксиды металлов главной подгруппы первой группы (щелочные металлы) Li — Fr Оксиды металлов главной подгруппы второй
- 8. 3) с водой (реагируют оксиды только самых активных металлов – щелочных и щелочноземельных): CaO + H2O
- 9. Кислотные оксиды – это сложные вещества, состоящие из неметалла и кислорода, которым соответствуют кислоты
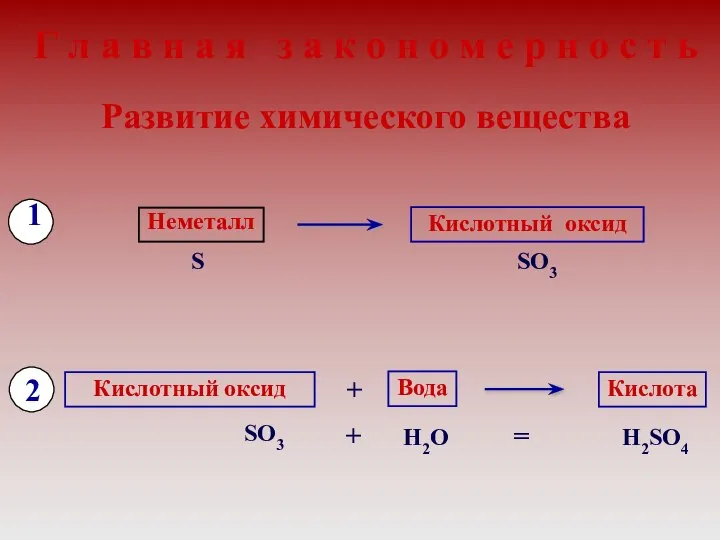
- 10. Г л а в н а я з а к о н о м е р
- 11. 3) с водой: SO3 + H2 O = H2 SO4 Химические свойства кислотных оксидов Кислотные оксиды
- 12. Несолеобразующие оксиды, образованные неметаллами: Они не взаимодействуют с водой, им не соответствуют кислоты. +2 + +2
- 13. Основания – это вещества, состоящие из металла и гидроксильных групп OH- (диссоциирующие с образованием гидроксид-ионов OH-)
- 14. образуют
- 15. Малоактивные металлы ( все, кроме щелочных и щелочноземельных ): Al, Zn, Cu, Fe, Pb образуют
- 16. металлы с меньшей степенью окисления образуют более сильные основания Fe(OH)2 > Fe(OH)3 +2 +3
- 17. Получение сильных оснований 1) оксид с водой: CaO + H2O = Ca(OH)2 2) металл с водой:
- 18. Получение слабых оснований Соль малоактивного металла со щелочью: CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
- 19. 2) с кислотными оксидами: 2NaOН + CO2 = Na2CO3 + H2O; 3) с солями (если образуется
- 20. Амфотерные гидроксиды обладают двойственными свойствами – и оснований и кислот одновременно. Они реагируют и с кислотами
- 21. Металлы, образующие амфотерные гидроксиды
- 22. Амфотерные свойства гидроксида цинка Zn(OH)2: амфот. Zn(OH)2 + H2 SO4 = ZnSO4 + 2H2 O основание
- 23. В расплаве: амфот. Zn(OH)2 + 2NaOH = H2ZnO2 + 2NaOH = кислота основание = Na2ZnO2 +
- 24. В растворе: Zn(OH)2 + 2NaOH = Na2[ Zn(OH)4 ]
- 25. Амфотерные свойства гидроксида алюминия: амфот. 2Al(OH)3 + 3H2 SO4 = Al2 (SO4)3 + 6H2 O основание
- 26. В расплаве: амфот. Al(OH)3 + 3NaOH = H3AlO3 + NaOH = NaAlO2 + 2H2O кислота основание
- 27. В растворе: Al(OH)3 + 3NaOH = Na3 [ Al(OH)6 ] или Na [ Al(OH)4 ]
- 28. Металлы с одинаковой степенью окисления (+2 или +3) образуют амфотерные гидроксиды с аналогичными свойствами
- 29. Кислоты – это сложные соединения, диссоциирующие с образованием катионов водорода H+ (протонов)
- 30. Кислоты и соли
- 31. Кислоты и соли
- 32. 3) с солями (если образуется осадок или газ): а) H2SO4 + BaCl2 = BaSO4↓ + 2HCl
- 33. Взаимодействие кислот с металлами Обычные: Окислителем является: Обычные кислоты реагируют с металлами с выделением водорода
- 34. Взаимодействие кислот с металлами Ряд напряжений металлов H Cu, Hg, Ag, Pt, Au Металлы, расположенные в
- 35. Взаимодействие кислот с металлами Кислоты-окислители: конц. конц. разб. Окислителем является кислотообразующий элемент: Кислоты-окислители реагируют с металлами
- 36. Примеры: конц. разб.
- 37. Соли – электролиты, диссоциирующие на катионы металла и анионы кислотного остатка
- 38. Средние соли состоят из металла и кислотного остатка
- 39. Кислые соли (гидросоли) состоят из катиона металла и сложного аниона, содержащего водород и кислотный остаток
- 40. Основные соли (гидроксосоли) состоят из сложного катиона, содержащего металл и гидроксильную группу, и аниона кислотного остатка
- 41. 2) с кислотами (если образуется осадок или выделяется газ): AgNO3 + HCl = AgCl↓ + HNO3,
- 42. Периодичность изменения кислотно-основных свойств химических веществ
- 43. Кислотно-основные свойства сложных соединений зависят от свойств элементов, из которых они образовались: 1. Свойства элементов в
- 45. Скачать презентацию


















![В растворе: Zn(OH)2 + 2NaOH = Na2[ Zn(OH)4 ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1177928/slide-23.jpg)


![В растворе: Al(OH)3 + 3NaOH = Na3 [ Al(OH)6 ] или Na [ Al(OH)4 ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1177928/slide-26.jpg)
















 Электрохимия
Электрохимия Реакции ионного обмена
Реакции ионного обмена pervonachalnye_svedenia_ob_org_v-kh
pervonachalnye_svedenia_ob_org_v-kh Хим_10_30_Производство_аммиака
Хим_10_30_Производство_аммиака Кислоты. Свойства кислот
Кислоты. Свойства кислот Фенолы
Фенолы Алкены. Строение
Алкены. Строение Основания
Основания Органические вещества
Органические вещества Простые вещества – металлы. Общие физические свойства металлов
Простые вещества – металлы. Общие физические свойства металлов Образование дипептида
Образование дипептида Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Висмут Bi
Висмут Bi Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора
Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора Spectroscopy. U.V. Lect.2
Spectroscopy. U.V. Lect.2 Дизайн молекулярных магнетиков
Дизайн молекулярных магнетиков Физическое явление в химии
Физическое явление в химии Соединения азота
Соединения азота Газовые законы
Газовые законы Химические явления. Закон сохранения массы веществ
Химические явления. Закон сохранения массы веществ Интересные свойства пластика
Интересные свойства пластика ЛКМ на основе кремнийорганических соединений
ЛКМ на основе кремнийорганических соединений Азот
Азот Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Презентация на тему Значение Периодического закона Д.И.Менделеева
Презентация на тему Значение Периодического закона Д.И.Менделеева  Алканы 10-класс
Алканы 10-класс Енергетика хімічних реакцій
Енергетика хімічних реакцій Презентация на тему Витамины. Урок химии 10 класс
Презентация на тему Витамины. Урок химии 10 класс