Слайд 2Цель урока:
Изучение реакций ионного обмена и условий их протекания.

Слайд 3Ответьте на вопросы
1.Какие вещества называются электролитами? Приведите примеры.
2. Какие вещества называются неэлектролитами?

Приведите примеры.
3. В каком году и кто разработал теорию электролитической диссоциации?
Слайд 4Выполните задания
1.Перечисленные вещества разделите на 2 столбика: в один запишите электролиты, в

другой – неэлектролиты: р-р КОН, тв.КОН, крист. сахара, Н2SO4, спирт, дист.вода.
2. Запишите уравнение диссоциации следующих веществ: КNO3, Ba(OH)2, HCL, H2SO4
Слайд 5Реакции между ионами называются ионными реакциями, а уравнения таких реакций – ионными

уравнениями.
Слайд 6 Реакции ионного обмена протекают до конца в случае
Выпадения осадка
Выделения газа
Образования малодиссоциирующего

вещества
Слайд 7Правила составления ионных уравнений
Простые вещества, оксиды, а также нерастворимые кислоты, основания, соли

не диссоциируют.
Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
Если в результате реакции образовалось малорастворимое вещество, то при записи ионного уравнения его считают нерастворимым.
Слайд 8Алгоритм составления ионного уравнения
Записать молекулярное уравнение реакции.
С помощью таблицы растворимости определить растворимость

каждого вещества.
Составить полное ионное уравнение
Составить сокращенное ионное уравнение (найти одинаковые ионы и сократить их слева и справа)
Слайд 9Лабораторная работа
Тема: Реакции ионного обмена
1 группа Взаимодействие растворов NaOH и CuSO4
2 группа

Взаимодействие растворов Na2CO3 и HCl
3 группа Взаимодействие растворов NaOH и HCl
Слайд 12Оцените свою работу по направлениям
«Я» - как я себя чувствовал в процессе

урока, доволен ли я своей работой;
«Мы» - насколько комфортно и эффективно мне было работать в группе;
«Дело» - достиг ли я цели обучения, в чём испытал затруднения, как преодолеть проблемы.










 Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Металлы p-семейства
Металлы p-семейства Основы кристаллографии
Основы кристаллографии Asymmetric Total Synthesis of Lancifodilactone G Acetate
Asymmetric Total Synthesis of Lancifodilactone G Acetate Химическое равновесие. Экзаменационные вопросы
Химическое равновесие. Экзаменационные вопросы Описние технологического процесса глубокой деструктивной переработки нефтяного сырья для получения высокооктанового бензина
Описние технологического процесса глубокой деструктивной переработки нефтяного сырья для получения высокооктанового бензина Стехиометрические законы химии
Стехиометрические законы химии AMFOTERNOST__1
AMFOTERNOST__1 Альдегиды
Альдегиды Презентация на тему Решение задач "выход продукта от теоретически возможного"
Презентация на тему Решение задач "выход продукта от теоретически возможного"  Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения
Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения Химия ионных жидкостей
Химия ионных жидкостей Винилпиридиновые каучуки
Винилпиридиновые каучуки Презентация на тему Бензол
Презентация на тему Бензол  Метод окислительно - восстановительного титрования
Метод окислительно - восстановительного титрования Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Общая характеристика галогенов
Общая характеристика галогенов Способы разделение смесей. 7 класс
Способы разделение смесей. 7 класс Галогенпроизводные углеводородов
Галогенпроизводные углеводородов Малотоннажные термопласты
Малотоннажные термопласты Цветные металлы и сплавы
Цветные металлы и сплавы Аналитическая химия. Гомогенные растворы
Аналитическая химия. Гомогенные растворы Кристаллохимические радиусы
Кристаллохимические радиусы Силикатная промышленность: Вчера, сегодня, завтра
Силикатная промышленность: Вчера, сегодня, завтра Органическая химия. Введение
Органическая химия. Введение Образование первичной структуры белка
Образование первичной структуры белка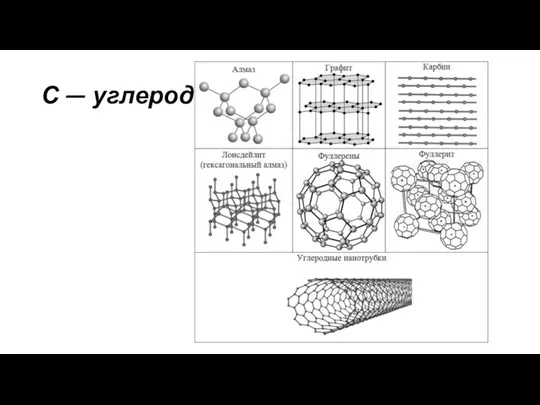 С - углерод. Применение
С - углерод. Применение Массообменные процессы
Массообменные процессы