Содержание
- 3. План лекции Структура, свойства и функции аминокислот Классификация аминокислот Природные пептиды Строение, свойства и функции белков
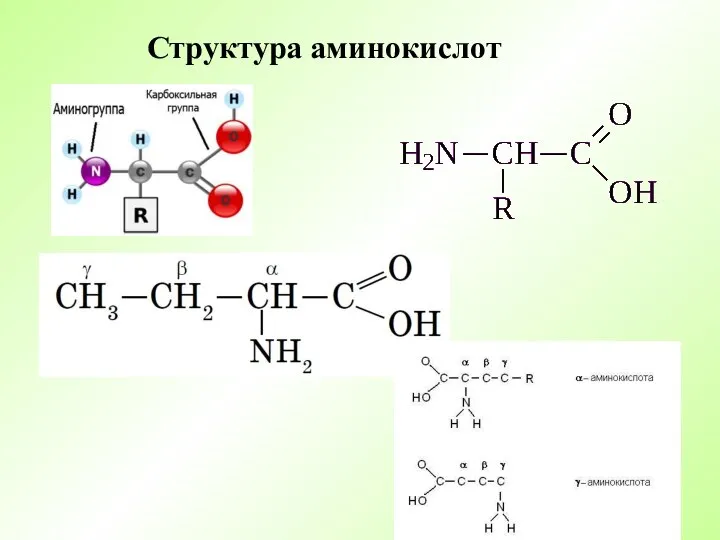
- 4. Структура аминокислот
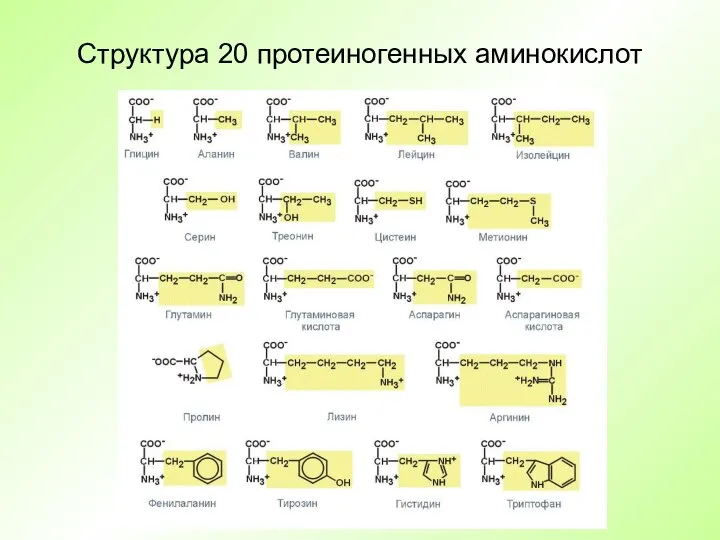
- 5. Структура 20 протеиногенных аминокислот
- 6. Физические свойства аминокислот Стереоизомерия: L и D формы – энантиомеры (хиральный центр) Изоэлектрическая точка рI –
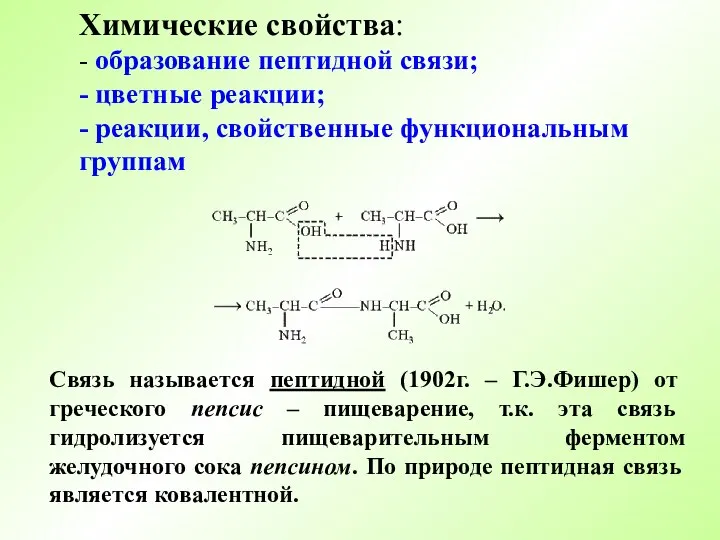
- 7. Химические свойства: - образование пептидной связи; - цветные реакции; - реакции, свойственные функциональным группам Связь называется
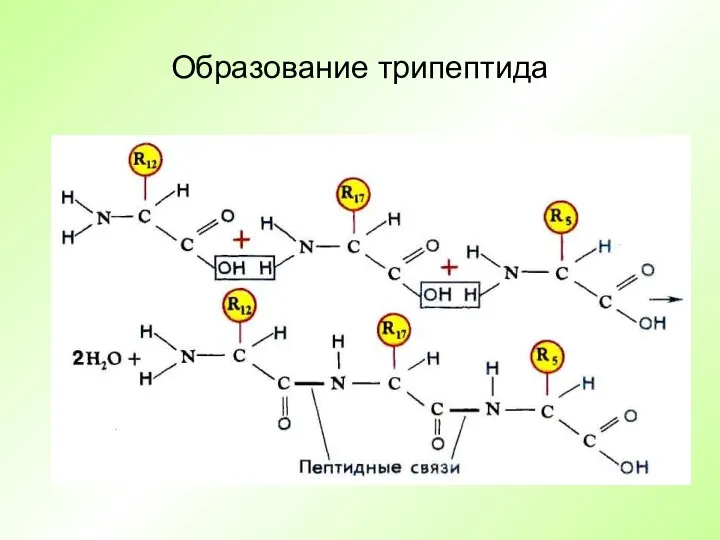
- 8. Образование трипептида
- 9. Биологические функции аминокислот Мономеры белков Входят в состав природных соединений (кофермента КоА – β-аланин; желчных кислот
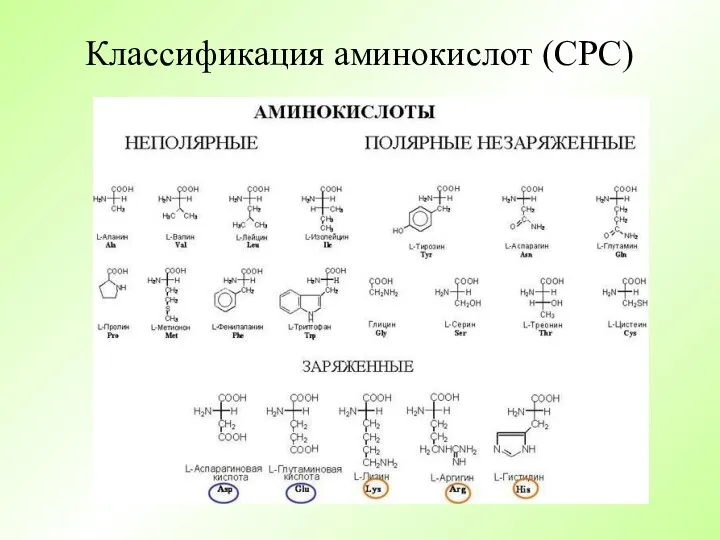
- 10. Классификация аминокислот (СРС)
- 11. Классификация по структуре радикала (СРС) Алифатические монокарбоновые кислоты: гли, ала, вал, лей, илей. Оксиаминокислоты (алифатические) :
- 12. Классификация аминокислот по биологическому и физиологическому значению (СРС) Заменимые: ГЛИ, АЛА, ПРО, АСП, АСН, ГЛУ, ГЛН,
- 13. Природные пептиды Две аминокислоты образуют дипептид: карнозин, ансерин – в мышечной ткани три аминокислоты – трипептид:
- 14. Белки – высокомолекулярные азотосодержащие органические полимеры. Они являются гетерополимерами (нерегулярные полимеры) и состоят из 20 мономеров
- 15. Размеры белков IgG, гемоглобин, инсулин, аденилаткиназа, глутаминсинтаза 150 kD, 16 kD, 5,5 kD,
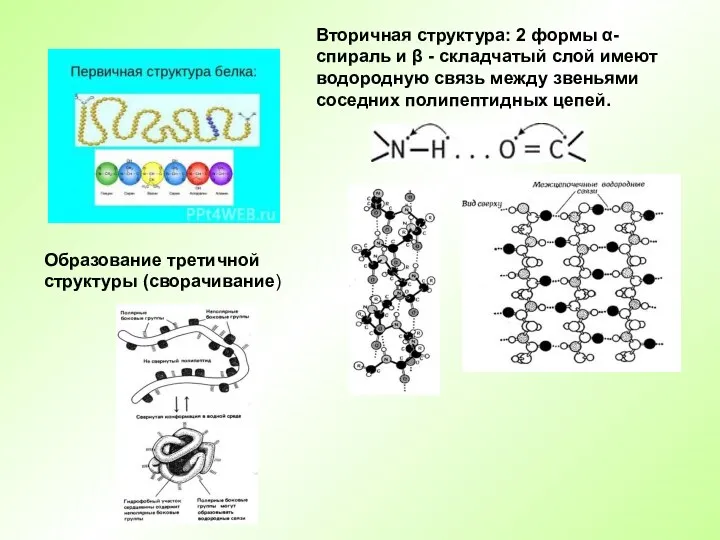
- 16. Структурная организация белков (Уровни организации белков) Первичная Вторичная Третичная Четвертичная
- 17. Вторичная структура: 2 формы α-спираль и β - складчатый слой имеют водородную связь между звеньями соседних
- 18. Биологическая роль белков Пластическая: миозин, актин, коллаген Каталитическая: ферменты Регуляторная: инсулин Защитная: иммуноглобулины Транспортная: ферритин Пищевая
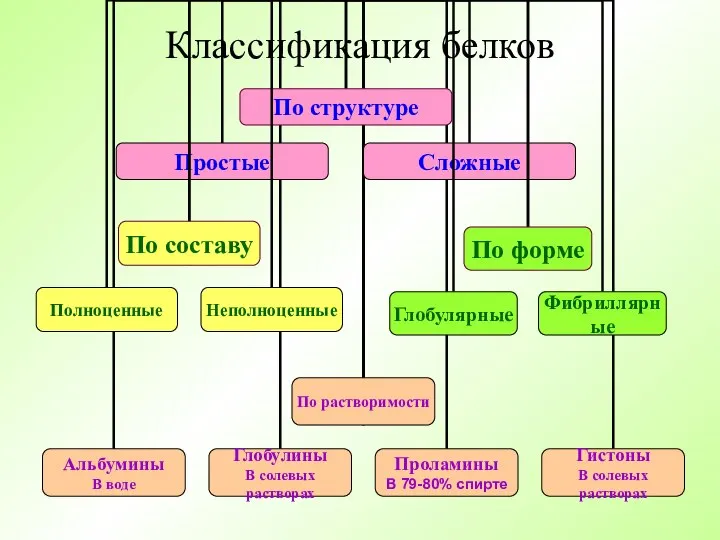
- 19. Классификация белков
- 20. Сложные белки имеют простетические группы Гликопротеины (содержат углеводы). Липопротеины (содержат липиды). Фосфопротеины (содержат фосфорную кислоту). Хромопротеины
- 21. Классификация белков по функциям Структурные – входят в различные структуры клетки и организма. Ферменты – являются
- 22. Физико-химические свойства белков Высокий молекулярный вес: 16 000-1 000 000: Высокая вязкость, способность к набуханию, низкое
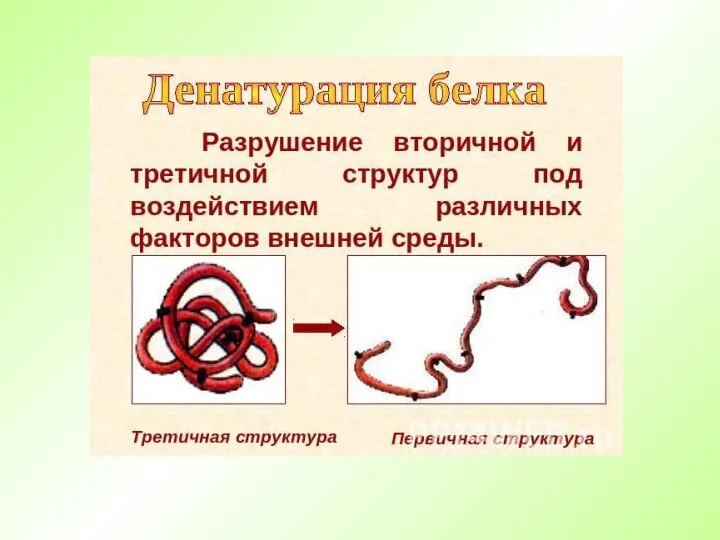
- 23. Денатурация Денатурация – это нарушение пространственной структуры белка и изменение нативных свойств белка при воздействии на
- 25. Ренатурация Ренатурация – восстановление нативной пространственной структуры и свойств белка (биологической активности) Для этого необходимо очень
- 26. Методы выделения белков Высаливание белков: (NH4)SO4 - снимается гидратная оболочка, белок сохраняет свою структуру, все связи,
- 27. Методы выделения и очистки белков экстракция белков водными или водно-солевыми растворами; диализ; электрофорез; хроматография: аффинная, гель-проникающая;
- 29. Скачать презентацию


















 Аэрированный сшитый полимерный раствор (АСПР)
Аэрированный сшитый полимерный раствор (АСПР) Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Химическая связь (8 класс)
Презентация на тему Химическая связь (8 класс)  Разнообразие веществ. 3 класс
Разнообразие веществ. 3 класс Углерод
Углерод Свойства аминов
Свойства аминов Электрохимия. Экзаменационные вопросы
Электрохимия. Экзаменационные вопросы Термохимия. Термодинамические параметры
Термохимия. Термодинамические параметры Презентация на тему Полимеры и их получение
Презентация на тему Полимеры и их получение  Альдегиды, строение и свойства
Альдегиды, строение и свойства Обратимые и необратимые химические реакции. Химическое равновесие
Обратимые и необратимые химические реакции. Химическое равновесие Неорганические вещества клетки
Неорганические вещества клетки Энергетические уровни
Энергетические уровни Обобщение свойств углеводородов
Обобщение свойств углеводородов Урок №10 12 класс
Урок №10 12 класс Презентация на тему Подготовка к ГИА по химии
Презентация на тему Подготовка к ГИА по химии  Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Фуллерены (шары Бакминстера)
Фуллерены (шары Бакминстера) Селективная экстракция отдельных групп БАВ сверхкритическими флюидами
Селективная экстракция отдельных групп БАВ сверхкритическими флюидами Нефть и способы ее переработки. Октановое число - что это?
Нефть и способы ее переработки. Октановое число - что это? Сера - химический элемент и простое вещество
Сера - химический элемент и простое вещество ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Структура и функции нуклеиновых кислот
Структура и функции нуклеиновых кислот Сухая вода помогла измерить поляризацию ковалентных связей
Сухая вода помогла измерить поляризацию ковалентных связей Презентация на тему Всё об алюминии
Презентация на тему Всё об алюминии  Смог як хімічне явище
Смог як хімічне явище Реакции ионного обмена
Реакции ионного обмена Презентация на тему Лекарства 10 класс
Презентация на тему Лекарства 10 класс