Содержание
- 2. Фарадей Майкл 22. IX.1791 – 25.VIII. 1867 Английский физик и химик. В первой половине 19 в.
- 3. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД) В 1887 году шведский учёный С. Аррениус для объяснения особенностей водных растворов
- 4. Вещества Электролиты – Неэлектролиты – проводят эл.ток в растворах не проводят эл. ток в растворах Тип
- 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ 1 ПОЛОЖЕНИЕ Все вещества по их способности проводить электрический ток в растворах делятся на
- 6. Процесс распада электролита на ионы называется электролитической диссоциацией. Химический словарь
- 7. 2 ПОЛОЖЕНИЕ При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы Ионы –
- 8. ИОНЫ - это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
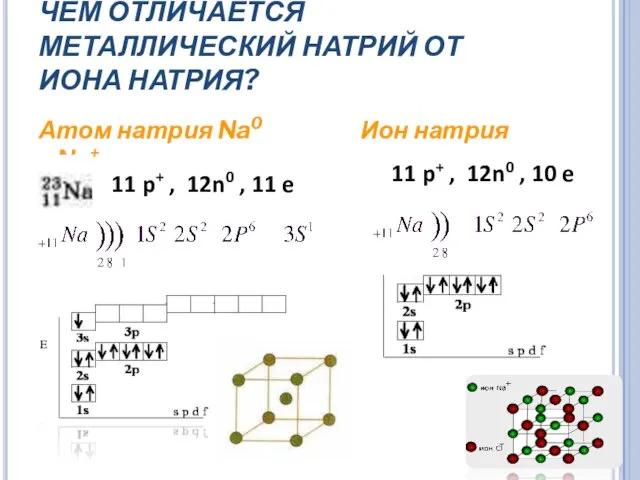
- 9. ЧЕМ ОТЛИЧАЕТСЯ МЕТАЛЛИЧЕСКИЙ НАТРИЙ ОТ ИОНА НАТРИЯ? Атом натрия Na0 Ион натрия Na+ 11 p+ ,
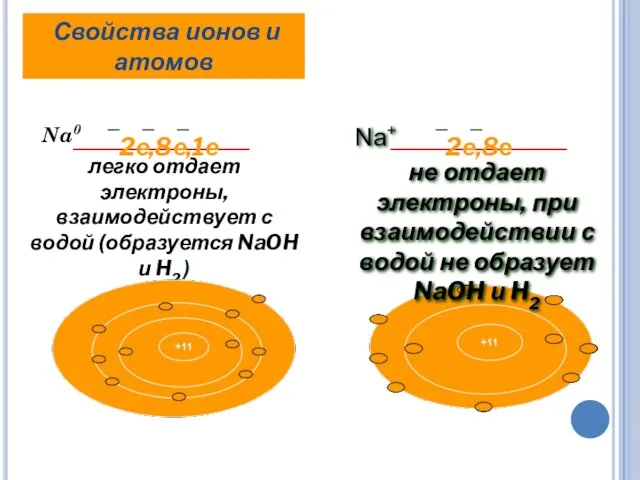
- 10. Na0 легко отдает электроны, взаимодействует с водой (образуется NaOH и H2 ) Свойства ионов и атомов
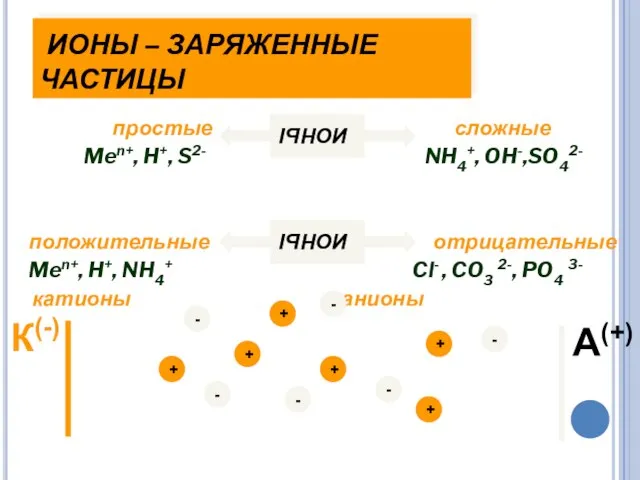
- 11. ИОНЫ – ЗАРЯЖЕННЫЕ ЧАСТИЦЫ простые сложные Men+, H+, S2- NH4+, OH-,SO42- положительные отрицательные Men+, H+, NH4+
- 12. 3 ПОЛОЖЕНИЕ Причиной диссоциации электролита является его взаимодействие с молекулами воды и разрыв химической связи в
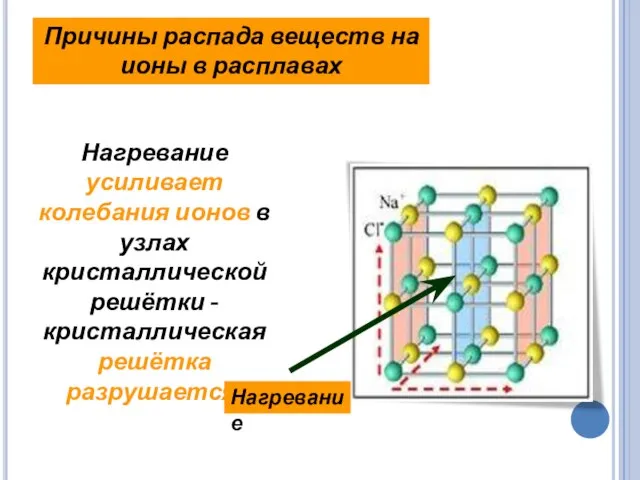
- 13. Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая решётка разрушается. Причины распада веществ на ионы
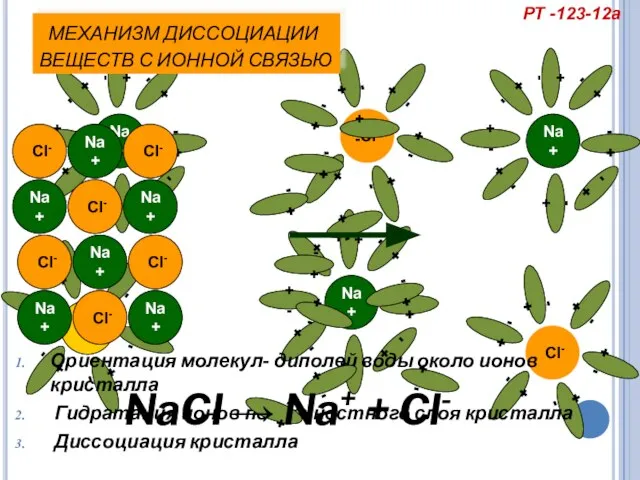
- 14. МЕХАНИЗМ ДИССОЦИАЦИИ ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮ Ориентация молекул- диполей воды около ионов кристалла Гидратация ионов поверхностного
- 15. СУЩНОСТЬ ПРОЦЕССА ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮ ориентация молекул воды вокруг полюсов молекулы электролита
- 17. Скачать презентацию









 Марганец. Калий
Марганец. Калий Свойства воды
Свойства воды Химия в сельском хозяйстве, быту, медицине
Химия в сельском хозяйстве, быту, медицине 20140111_mineraly
20140111_mineraly Структуры железоуглеродистых сплавов в равновесном состоянии
Структуры железоуглеродистых сплавов в равновесном состоянии Свине́ц (Plumbum;Pb)
Свине́ц (Plumbum;Pb) Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Презентация на тему Неметаллы, особенности строения
Презентация на тему Неметаллы, особенности строения  Своя игра. Металлы и неметаллы
Своя игра. Металлы и неметаллы Алканы
Алканы Презентация на тему Фенол и его свойства
Презентация на тему Фенол и его свойства  Простые и сложные вещества (8 класс)
Простые и сложные вещества (8 класс) Белки молока и молочных продуктов. Виды белков
Белки молока и молочных продуктов. Виды белков Валентность
Валентность Материальный и тепловой балансы абсорбции
Материальный и тепловой балансы абсорбции Легированные стали
Легированные стали Классификация методов аналитической химии
Классификация методов аналитической химии Алкилирование. Алкилирующие агенты
Алкилирование. Алкилирующие агенты Минералы
Минералы Игра по химии Классики
Игра по химии Классики Химические реакции
Химические реакции Фосфор в природе
Фосфор в природе Предельные одноатомные спирты
Предельные одноатомные спирты Протравка стекла с помощью ионного обмена
Протравка стекла с помощью ионного обмена Практико-ориентировочный проект Оксиды на службе у человека
Практико-ориентировочный проект Оксиды на службе у человека Электролиз (катод)
Электролиз (катод) Циклоалканы. Физические свойства
Циклоалканы. Физические свойства Природные смолы: мирра, ладан и шеллак
Природные смолы: мирра, ладан и шеллак