Содержание
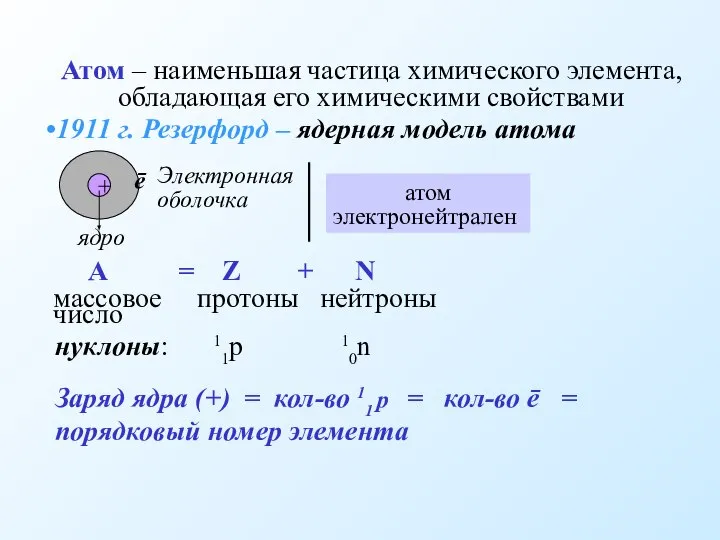
- 2. 1911 г. Резерфорд – ядерная модель атома А = Z + N массовое протоны нейтроны число
- 4. Изотопы – атомы с одинаковым зарядом ядра (и химическими свойствами), но разным массовым числом (числом 11n)
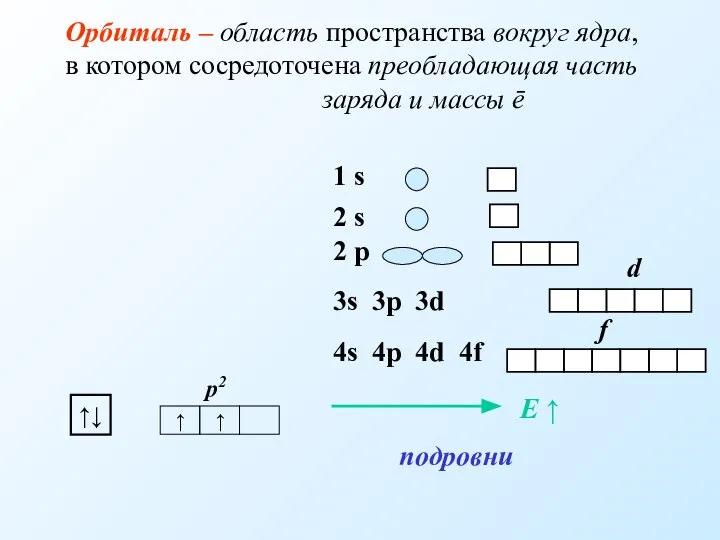
- 5. 1 s 2 s 2 p 3s 3p 3d 4s 4p 4d 4f подровни Е ↑
- 6. Max число ē: АО − 2 ē Энергетические подуровни − s2, p6, d10, f14 уровни 1
- 7. Принцип наименьшей Е Наиболее устойчивое состояние ē в атоме соответствует минимальному возможному значению его Е. Электронная
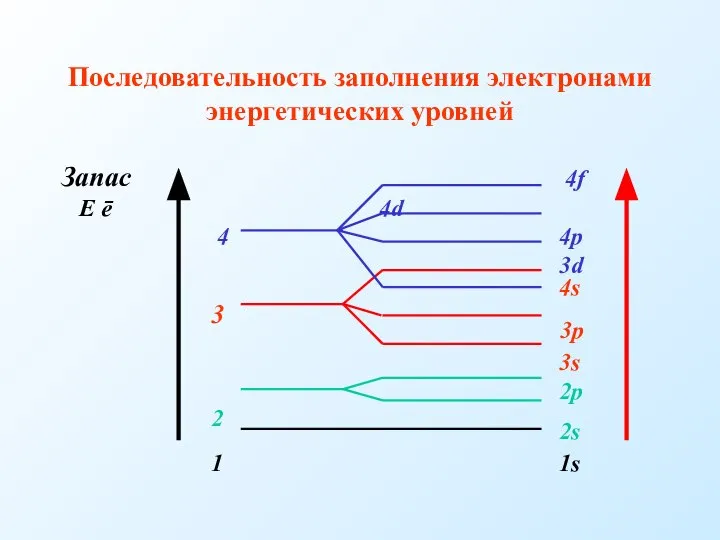
- 8. Последовательность заполнения электронами энергетических уровней Запас 4f Е ē 4d 4 4p 3d 4s 3 3p
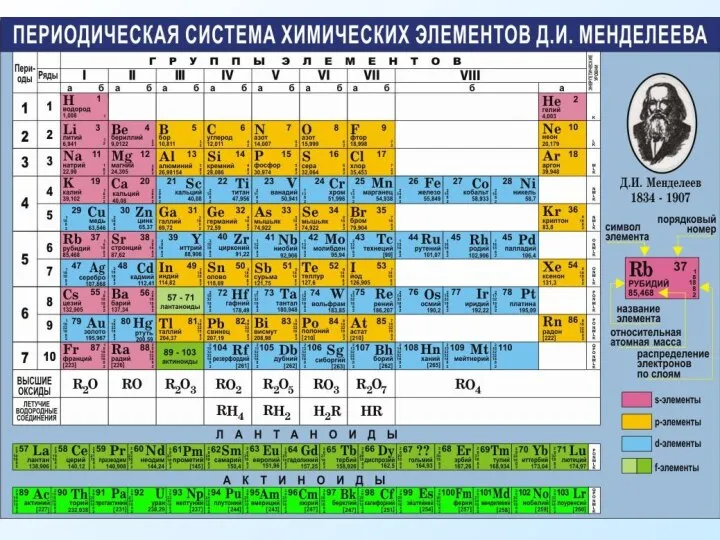
- 9. Порядок заполнения (электронная формула): 1s2 2s2 2p6 3s23p6 4s23d104p6 5s2 4d10 5p6 1 2 3 4
- 11. Скачать презентацию




 Презентация на тему Эфиры, жиры
Презентация на тему Эфиры, жиры  KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ;
KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ; Карбоновые кислоты
Карбоновые кислоты Полимеры
Полимеры Оксид серы (VI) SO3
Оксид серы (VI) SO3 Исследование влияния изменения технических параметров на производительность установки замедленного коксования
Исследование влияния изменения технических параметров на производительность установки замедленного коксования Использование разнообразных форм и методов обучения при подготовке учащихся к ЕГЭ по химии
Использование разнообразных форм и методов обучения при подготовке учащихся к ЕГЭ по химии Химия в жизни общества
Химия в жизни общества Презентация на тему Игра по химии «Остров Периодическая Система»
Презентация на тему Игра по химии «Остров Периодическая Система»  Минеральные ресурсы
Минеральные ресурсы Сурьма, Sb
Сурьма, Sb Минералы и горные породы
Минералы и горные породы Типы кристаллических решёток
Типы кристаллических решёток Влияние на скорость ферментативной реакции
Влияние на скорость ферментативной реакции Дисперсные системы и поверхностные явления
Дисперсные системы и поверхностные явления Газ Хлор
Газ Хлор Газообразные (газ)
Газообразные (газ) Молекулярная химия
Молекулярная химия Применение арт-технологии на уроках химии Обобщение опыта педагогической деятельности МОУ СОШ № 14 город Мончегорск Мурманск
Применение арт-технологии на уроках химии Обобщение опыта педагогической деятельности МОУ СОШ № 14 город Мончегорск Мурманск Исследование кокаина методом ГХ-МС
Исследование кокаина методом ГХ-МС Очистка поваренной соли методом кристаллизации в домашних условиях
Очистка поваренной соли методом кристаллизации в домашних условиях Полиуретановые полимеры
Полиуретановые полимеры Классификация методов аналитической химии
Классификация методов аналитической химии Заманауи косметика биотехнологиясы
Заманауи косметика биотехнологиясы Явления, смеси и способы их разделения
Явления, смеси и способы их разделения Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год
Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Задачи на ионные равновесия
Задачи на ионные равновесия