Содержание
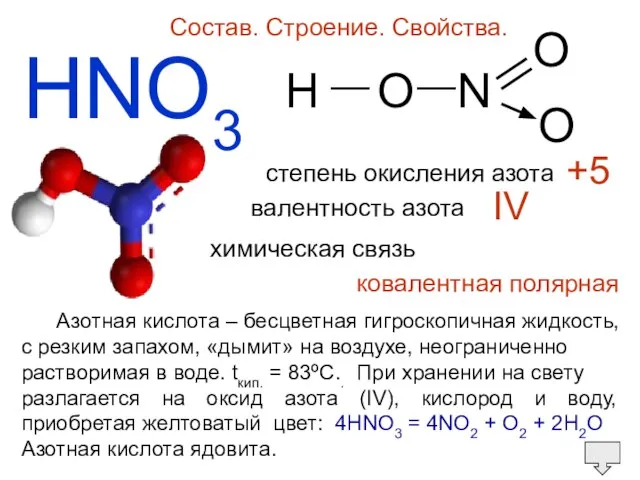
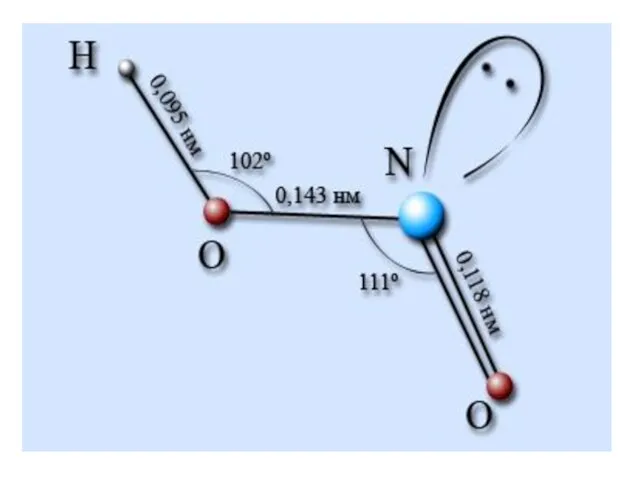
- 2. HNO3 Состав. Строение. Свойства. H O N O O — — степень окисления азота валентность азота
- 4. При разложении азотной кислоты выделяется кислород, поэтому скипидар вспыхивает.
- 5. Азотная кислота (HNO3) Классификация наличию кислорода: основности: растворимости в воде: летучести: степени электролитической диссоциации: кислородсодержащая одноосновная
- 6. Получение азотной кислоты в промышленности NH3 NO NO2 HNO3 4NH3+ 5O2 = 4NO + 6H2O 2NO+O2
- 7. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитраты при слабом нагревании. Составьте уравнение
- 8. Химические свойства азотной кислоты 1. Типичные свойства кислот 2. Взаимодействие азотной кислоты с металлами 3. Взаимодействие
- 9. Химические свойства азотной кислоты Азотная кислота проявляет все типичные свойства кислот. Перечислите свойства характерные для кислот.
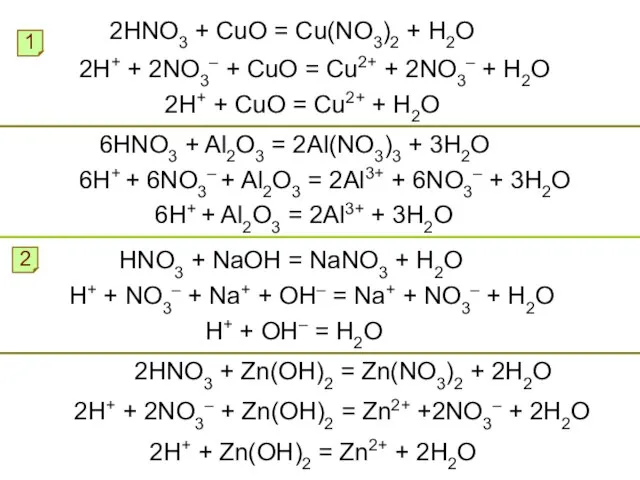
- 10. 2HNO3 + CuO = Cu(NO3)2 + H2O 1 2H+ + 2NO3– + CuO = Cu2+ +
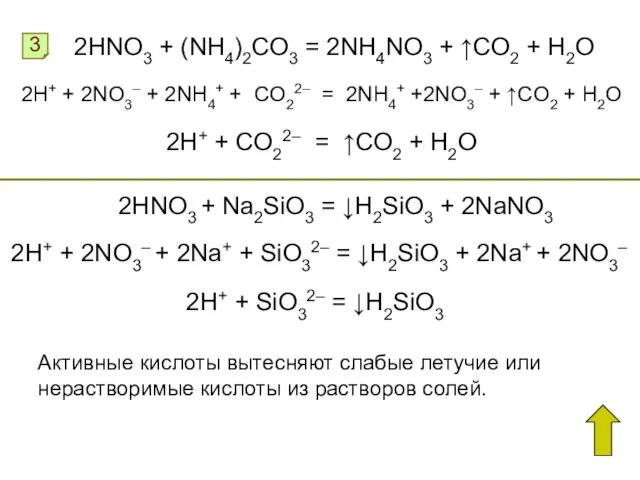
- 11. 3 2HNO3 + (NH4)2CO3 = 2NH4NO3 + ↑CO2 + H2O 2H+ + 2NO3– + 2NH4+ +
- 12. Взаимодействие азотной кислоты с металлами Как реагируют металлы с растворами кислот? Металлы, стоящие в ряду активности
- 13. Окислительные свойства азотной кислоты
- 14. Составьте уравнение реакции взаимодействия концентрированной азотной кислоты с ртутью. Рассмотрите реакцию с т. зр. ОВР. 4HN+5O3
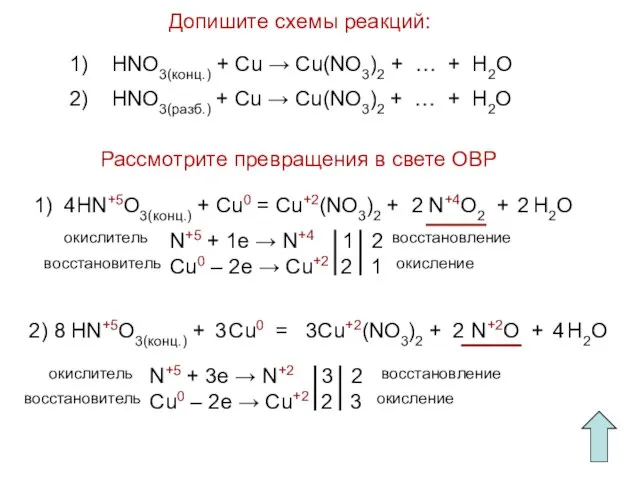
- 15. Допишите схемы реакций: Рассмотрите превращения в свете ОВР 1) HNO3(конц.) + Cu → Cu(NO3)2 + …
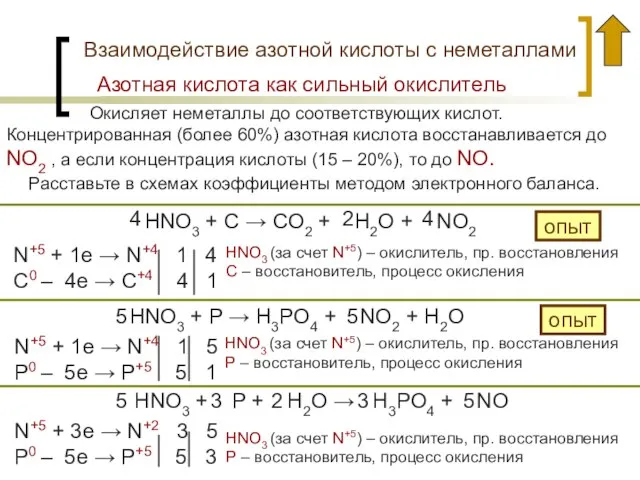
- 17. Взаимодействие азотной кислоты с неметаллами Окисляет неметаллы до соответствующих кислот. Концентрированная (более 60%) азотная кислота восстанавливается
- 18. Взаимодействие азотной кислоты с углем
- 19. Взаимодействие азотной кислоты с белым фосфором
- 20. Применение азотной кислоты 1 5 4 6 2 3 Производство азотных и комплексных удобрений. Производство взрывчатых
- 21. Соли азотной кислоты Как называются соли азотной кислоты? нитраты Нитраты K, Na, NH4+ называют селитрами Составьте
- 22. Нитрат калия (калиевая селитра) Бесцветные кристаллы Значительно менее гигроскопична по сравнению с натриевой, поэтому широко применя-ется
- 23. Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение
- 24. При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом ряду напряжений стоит металл, образующий соль.
- 26. Скачать презентацию

















 Клуб юных химиков. Школа №3
Клуб юных химиков. Школа №3 Кислород – это самый распространенный на нашей планете элемент
Кислород – это самый распространенный на нашей планете элемент Биологические буферные системы
Биологические буферные системы Адсорбция твёрдыми адсорбентами
Адсорбция твёрдыми адсорбентами Вывод химических формул
Вывод химических формул Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Обобщающий урок по теме «Соединения химических элементов» 8 класс.
Обобщающий урок по теме «Соединения химических элементов» 8 класс. Химическая связь в молекулах. Экзаменационные вопросы
Химическая связь в молекулах. Экзаменационные вопросы Сұрақтар
Сұрақтар Железо и его соединения. Строение атома железа
Железо и его соединения. Строение атома железа Презентация на тему Крахмал
Презентация на тему Крахмал  ОГЭ №1, вопрос 1-16
ОГЭ №1, вопрос 1-16 Понятие о предельных углеводородах. Алканы
Понятие о предельных углеводородах. Алканы Презентация на тему Углеводороды
Презентация на тему Углеводороды  Химическая связь и строение молекул
Химическая связь и строение молекул Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2) Теоретические основы органической химии
Теоретические основы органической химии Кристаллы, выращенные учащимися
Кристаллы, выращенные учащимися Химический анализ растворов этилового спирта черной смородины
Химический анализ растворов этилового спирта черной смородины Неделя химии в МБОУ (викторина)
Неделя химии в МБОУ (викторина) Соли (8 класс)
Соли (8 класс) Кислоты, их состав и название
Кислоты, их состав и название Оборудование и реактивы
Оборудование и реактивы Основной государственный экзамен. Химия 2022. Задание 2
Основной государственный экзамен. Химия 2022. Задание 2 Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  Комплексное изучение системы NiO-ZnO-CoO с целью модифицирования свойств исходной матрицы никель-цинкового феррита xZnxFe2O4
Комплексное изучение системы NiO-ZnO-CoO с целью модифицирования свойств исходной матрицы никель-цинкового феррита xZnxFe2O4 Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Степень окисления веществ
Степень окисления веществ