Содержание
- 2. 1. Формулы высших гидроксидов А. H2SO3 Б) H2S В) Fe(OH)2 Г) H2SiO3
- 3. 2. Формулы высших гидроксидов А. H2CO3 Б) HNO2 В) Al(OH)3 Г) HCl
- 4. 3. Формулы высших гидроксидов А) HNO3 Б) HBrO В) Ca(OH)2 Г) H3РО4
- 5. Характер высшего гидроксида
- 6. 4. Формулы высших основных гидроксидов А. Ca(OH)2 Б) NaOH В) Al(OH)3 Г) H3PO4
- 7. 5. Формула высшего основного гидроксида А. HNO3 Б) H2SiO3 В) H2SO3 Г) Mg(OH)2
- 8. 6. Формулы высших кислотных гидроксидов А. Mg(OH)2 Б) H3BO3 В) LiOH Г) H2SO4
- 9. 7. Формулы высших кислотных гидроксидов А. H2CO3 Б) Ca(OH)2 В) KOH Г) HClO4
- 10. 8. Формула высшего амфотерного гидроксида А. Mg(OH)2 Б) Zn(OH)2 В) LiOH Г) HNO3
- 11. 9. Формула высшего амфотерного гидроксида А. H3PO4 Б) Al(OH)3 В) Cu(OH)2 Г) KOH
- 12. 10. Напишите формулу высшего гидроксида и охарактеризуйте его свойства для элементов А. Si Б) C В)
- 13. 10. Проверим! А. Н2SiО3- кислота Б) Н2CО3- кислота В) Al(ОН)3 - амфотерный гидроксид Г) НNО3 -
- 14. 11. Напишите формулу высшего гидроксида и охарактеризуйте его свойства для элементов А. Ва Б) P В)
- 15. 11. Проверим! А) Ва(ОН)2 - основание Б) Н3PО4 - кислота В) Н2SiО3 - кислота Г) NaОН
- 16. Изменение свойств высших гидроксидов
- 17. Основные свойства усиливаются в ряду высших гидроксидов А) KOH, Ca(OH)2, Fe(OH)3 Б) NaOH, H2SiO3, HClO4 В)
- 18. Кислотные свойства ослабевают в ряду высших гидроксидов А) LiOH ,H3BO3, H2CO3 Б) HNO3, Be(OH)2, LiOH В)
- 19. Расположите в ряд по усилению кислотных свойств высшие гидроксиды элементов Проверим! Li, N, B, C, Be
- 20. Расположите в ряд по усилению основных свойств высшие гидроксиды элементов Проверим! Al, Na, P, S, Mg,
- 21. Как изменяются свойства высших гидроксидов в ряду LiOH – NaOH – KOH А) усиливаются кислотные свойства;
- 22. Как изменяются свойства высших гидроксидов в ряду HClO4 – H2SiO3 – Al(OH)3 – NaOH А) усиливаются
- 23. Молодцы!
- 25. Скачать презентацию






















 Понятие о полимерах
Понятие о полимерах Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Природные источники углеводородов. Нефть и природный газ
Природные источники углеводородов. Нефть и природный газ Структура и функции нуклеиновых кислот
Структура и функции нуклеиновых кислот Природные кристаллы
Природные кристаллы Физическая химия тугоплавких неметаллических и силикатных материалов (ТНСМ)
Физическая химия тугоплавких неметаллических и силикатных материалов (ТНСМ) Презентация на тему Медь
Презентация на тему Медь  Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье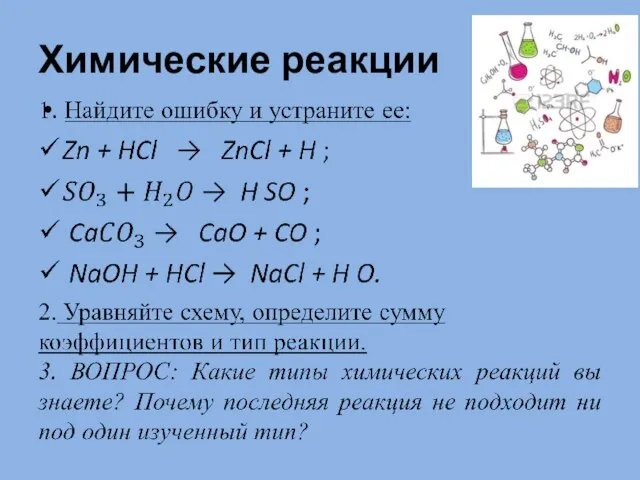 Химические реакции
Химические реакции Презентация на тему Строение газообразных, жидких и твердых тел
Презентация на тему Строение газообразных, жидких и твердых тел  Аналитический подход к моделированию. Физико-химическое моделирование
Аналитический подход к моделированию. Физико-химическое моделирование Коррозия металлов
Коррозия металлов Гальванические элементы
Гальванические элементы Кристаллическое состояние полимеров
Кристаллическое состояние полимеров Гальванические элементы
Гальванические элементы Учебная дисциплина Естествознание. Раздел II. Химия
Учебная дисциплина Естествознание. Раздел II. Химия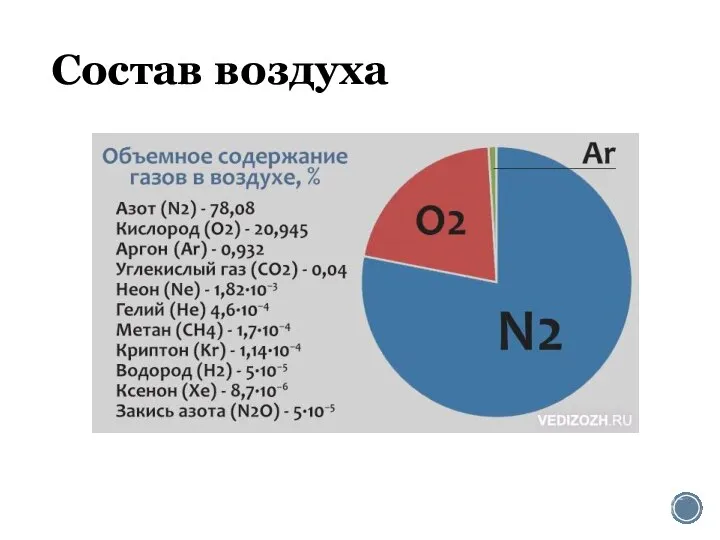 Состав воздуха. Азот
Состав воздуха. Азот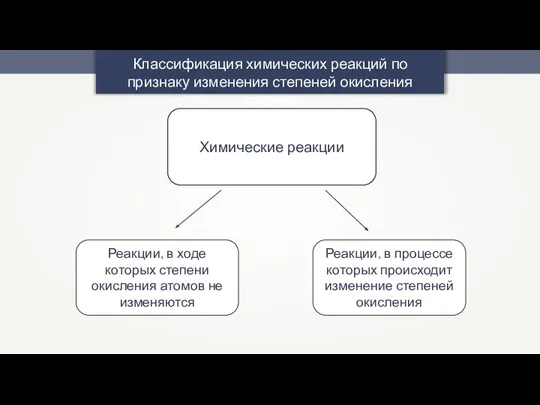 Окислительно-восстановительные реакции. Электролиз
Окислительно-восстановительные реакции. Электролиз Введение. Тренажер
Введение. Тренажер Кислоты, основания и соли как электролиты
Кислоты, основания и соли как электролиты Каучук и резиновые материалы
Каучук и резиновые материалы Ароматические вещества и их значение для человека
Ароматические вещества и их значение для человека Электролиз и его применение
Электролиз и его применение Геометрия молекул
Геометрия молекул Получение металлов
Получение металлов Растворы. Часть 2
Растворы. Часть 2 Logo кроссворд первоначальные понятия. 8 класс
Logo кроссворд первоначальные понятия. 8 класс Изменения, происходящие с веществами Урок химии 8 класс Учитель химии МОУ «СОШ №7» г. Балаково Саратовская обл.
Изменения, происходящие с веществами Урок химии 8 класс Учитель химии МОУ «СОШ №7» г. Балаково Саратовская обл.