Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Содержание
- 2. Межмолекулярные взаимодействия Это взаимодействия между валентно-насыщенными атомами Более широкое понятие – невалентные взаимодействия (внутримолекулярные, межмолекулярные, между
- 3. Роль межмолекулярных взаимодействий Переходы между агрегатными состояниями Физические свойства, связанные с энергией взаимодействия (теплота и температура
- 4. Виды межмолекулярных взаимодействий Специфические – обладают свойством направленности и зависят от наличия и расположения определенных типов
- 5. Специфические взаимодействия Водородные связи Галогенные связи Стэкинг-взаимодействия Слабые донорно-акцепторные взаимодействия
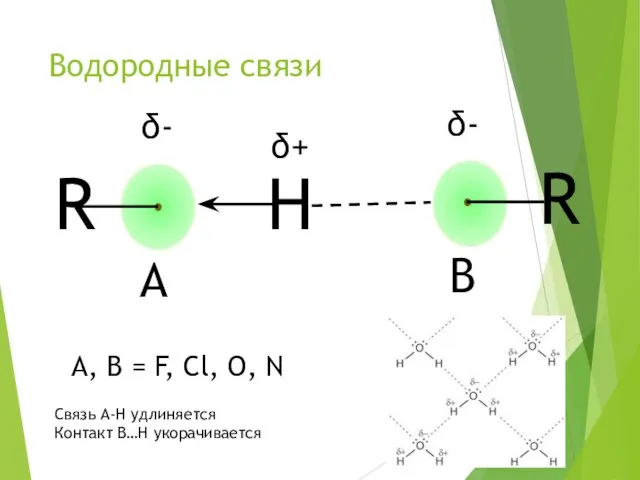
- 6. Водородные связи A, B = F, Cl, O, N Связь A-H удлиняется Контакт B…H укорачивается
- 7. Водородные связи Геометрия водородных связей
- 8. Водородные связи
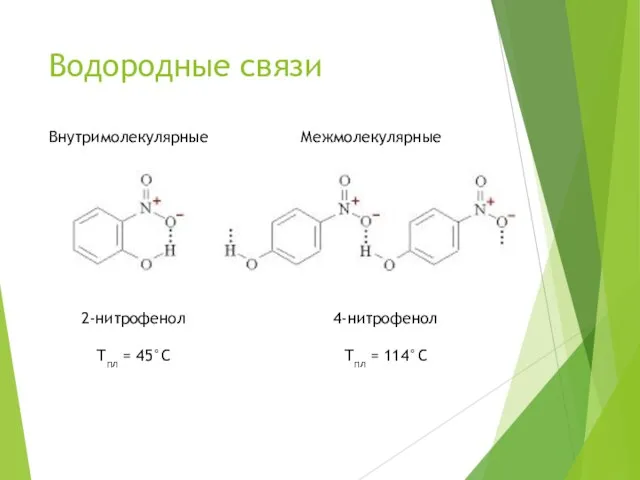
- 9. Водородные связи Внутримолекулярные Межмолекулярные 2-нитрофенол 4-нитрофенол Тпл = 45°С Тпл = 114°С
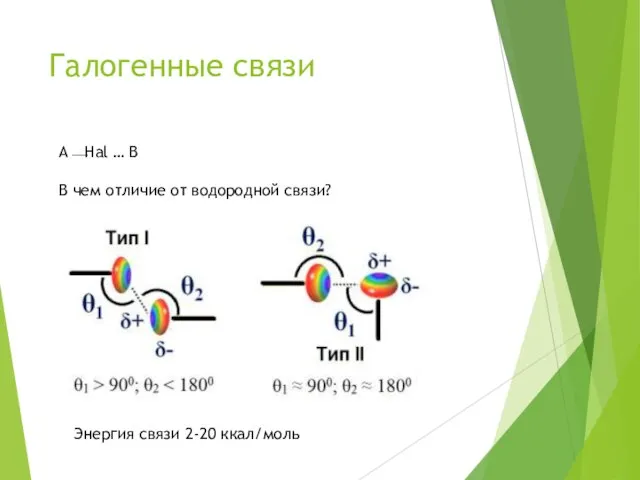
- 10. Галогенные связи A⎯Hal … B В чем отличие от водородной связи? Наличие «σ-дырки» – области положительного
- 11. Галогенные связи A⎯Hal … B В чем отличие от водородной связи? Энергия связи 2-20 ккал/моль
- 12. Другие специфические взаимодействия A⎯X … B X = S, Se, Te – халькогенные связи X =
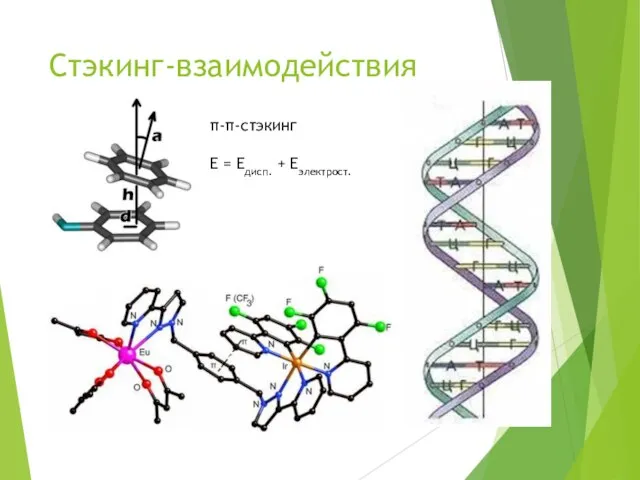
- 13. Стэкинг-взаимодействия π-π-стэкинг E = Eдисп. + Eэлектрост.
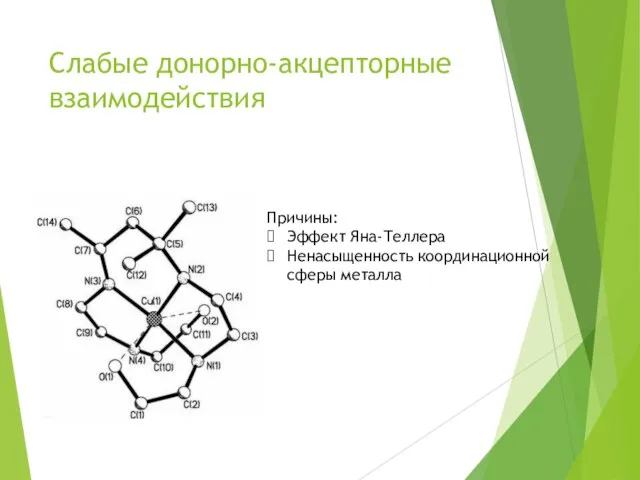
- 14. Слабые донорно-акцепторные взаимодействия Причины: Эффект Яна-Теллера Ненасыщенность координационной сферы металла
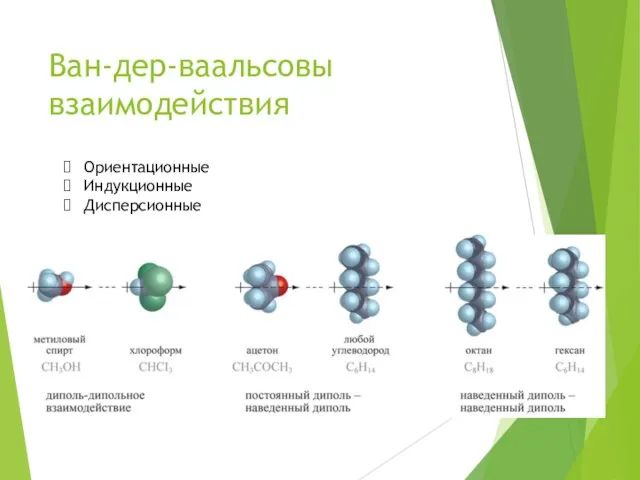
- 15. Ван-дер-ваальсовы взаимодействия Ориентационные Индукционные Дисперсионные
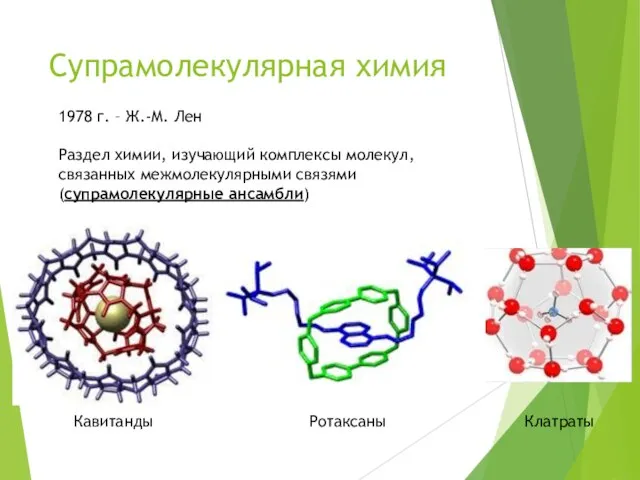
- 16. Супрамолекулярная химия 1978 г. – Ж.-М. Лен Раздел химии, изучающий комплексы молекул, связанных межмолекулярными связями (супрамолекулярные
- 18. Скачать презентацию








 Газообразные вещества и их применение
Газообразные вещества и их применение Порох. Сера, халькогены
Порох. Сера, халькогены Металлы. Строение, свойства, применение
Металлы. Строение, свойства, применение Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях
Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов
ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов Неметаллы – химические элементы
Неметаллы – химические элементы Презентация на тему Этиловый спирт и его влияние на организм человека
Презентация на тему Этиловый спирт и его влияние на организм человека  Хроматография
Хроматография Химическое равновесие. Задачи
Химическое равновесие. Задачи Вода и её свойства
Вода и её свойства Неметаллы. Контрольная работа. 9 класс
Неметаллы. Контрольная работа. 9 класс Радиоактивные превращения. Закон радиоактивного распада. Период полураспада
Радиоактивные превращения. Закон радиоактивного распада. Период полураспада Реакции обмена
Реакции обмена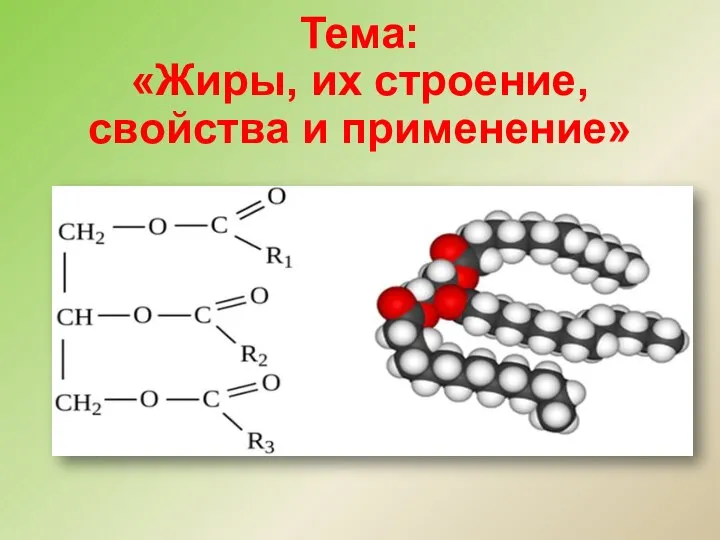 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Кислород
Кислород Хімічний експеримент
Хімічний експеримент Типичные реакции основных и кислотных оксидов
Типичные реакции основных и кислотных оксидов Физико-химические свойства нефтепродуктов
Физико-химические свойства нефтепродуктов Енергетика хімічних процесів
Енергетика хімічних процесів Использование элементов модульной технологии на уроках химии
Использование элементов модульной технологии на уроках химии Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Буферные системы
Буферные системы Первое начало термодинамики (Закон сохранения и превращения энергии)
Первое начало термодинамики (Закон сохранения и превращения энергии) Метод валентных связей
Метод валентных связей Очистка поваренной соли
Очистка поваренной соли Амины. Номенклатура
Амины. Номенклатура Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C
Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы
Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы