Содержание
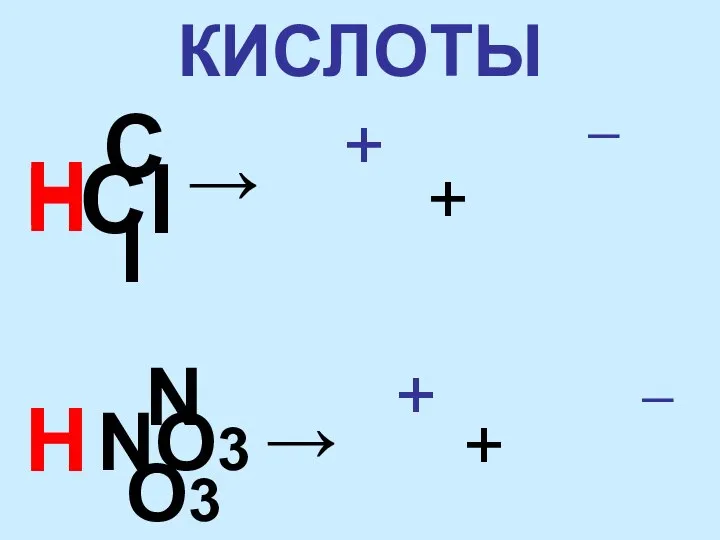
- 2. КИСЛОТЫ H + + → Cl _ H Cl H NO3 → H NO3 _ +
- 3. 1. КИСЛОТЫ – ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ ИОНОВ ВОДОРОДА И КИСЛОТНОГО ОСТАТКА. 2. КИСЛОТЫ –
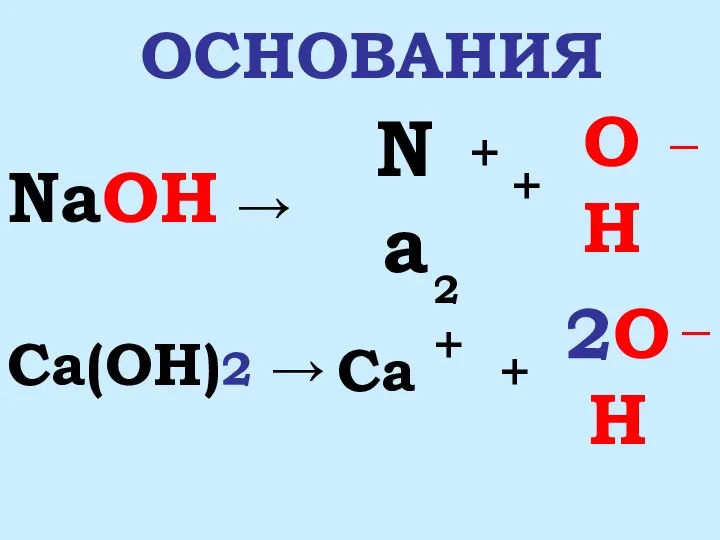
- 4. ОСНОВАНИЯ NaOH → Ca(OH)2 → Na + OH + _ Ca 2OH _ + 2+
- 5. 1. ОСНОВАНИЯ- ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ ИОНОВ МЕТАЛЛА И ГИДРОКСИД-ИОНОВ OH 2. ОСНОВАНИЯ- ЭТО ЭЛЕКТРОЛИТЫ,
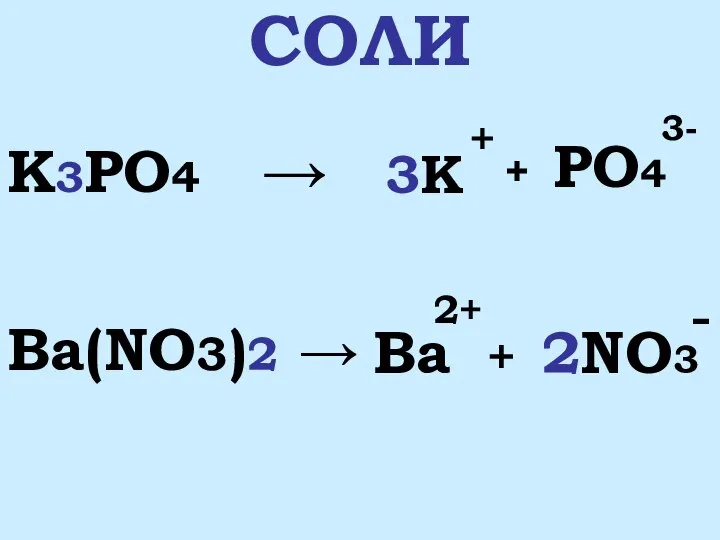
- 6. СОЛИ K3PO4 → Ba(NO3)2 → 3K + PO4 3- Ba 2+ + + 2NO3 -
- 7. 1. Соли – это сложные вещества, состоящие из ионов металла и ионов кислотного остатка 2. Соли
- 8. Реакции ионного обмена Определить растворимость веществ, подчеркнуть их; Под чертой написать уравнение их диссоциации (учитывая коэффициенты!!!).
- 9. Реакции обмена Реакции, в которых электролиты меняются ионами. Реакции между ионами ионного Условия протекания реакций ионного
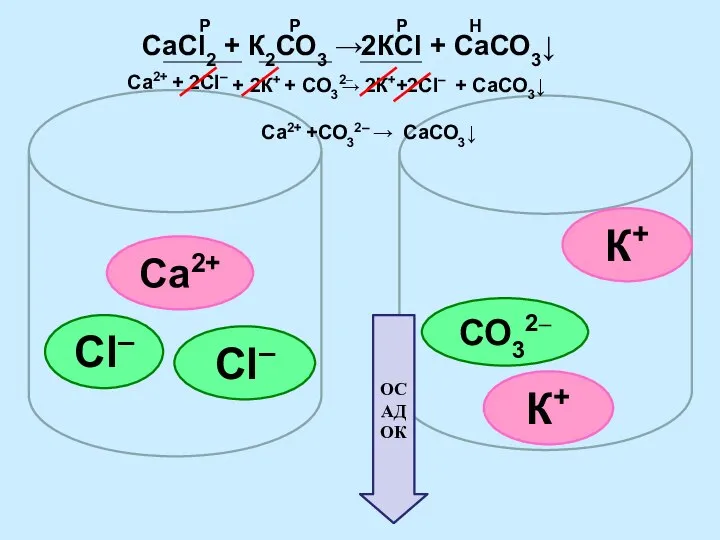
- 10. СаСl2 + К2СО3 → КСl + СаСО3↓ Са2+ Сl– Сl– К+ К+ СО32– ОСАДОК Р Р
- 12. Скачать презентацию





 Распространение ПВО в приземном слое атмосферы
Распространение ПВО в приземном слое атмосферы Неон
Неон Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Химия и география. Викторина
Химия и география. Викторина Дисперсные системы
Дисперсные системы Аминоксилоты. Общая формула аминокислот
Аминоксилоты. Общая формула аминокислот Кроссворд. Плотность
Кроссворд. Плотность Кислород и сера. Их положение в ПСХЭ. Значение и применение
Кислород и сера. Их положение в ПСХЭ. Значение и применение Высшие жирные кислоты липиды
Высшие жирные кислоты липиды Презентация на тему Подгруппа азота
Презентация на тему Подгруппа азота  Промышленное производство азотных удобрений
Промышленное производство азотных удобрений Химические реакции
Химические реакции Железо. Биологическое значение железа
Железо. Биологическое значение железа Металлы. Определения
Металлы. Определения Основания. Определение. Формулы
Основания. Определение. Формулы Спирты. Методы получения
Спирты. Методы получения Пуриновые основания
Пуриновые основания Характеристика углеводородов
Характеристика углеводородов Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Пултаруллă
Пултаруллă Кварцевые пески
Кварцевые пески Двовимірний ямр. Основні принципи
Двовимірний ямр. Основні принципи Чистые вещества и смеси
Чистые вещества и смеси Составление ионных уравнений
Составление ионных уравнений Спирты. Тест
Спирты. Тест Производство серной кислоты
Производство серной кислоты Общая характеристика элементов VII группы главной подгруппы. Хлор
Общая характеристика элементов VII группы главной подгруппы. Хлор Презентация на тему Законы электролиза
Презентация на тему Законы электролиза