Содержание
- 2. ЦЕЛЬ УРОКА: Повторить свойства металлов и неметаллов Изучить строениеатомов, свойства галогенов на основании их сравнительной характеристики.
- 4. ОТВЕТЫ ТЕСТА 1 вариант – неметаллы 2, 4, 5, 7, 10, 11, 13, 15 2 вариант
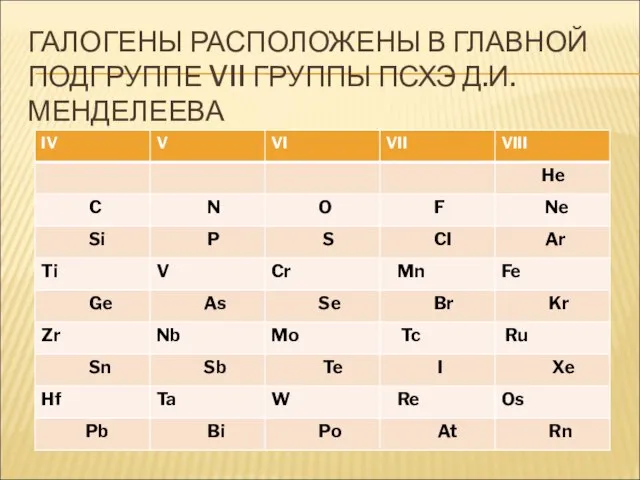
- 5. ГАЛОГЕНЫ РАСПОЛОЖЕНЫ В ГЛАВНОЙ ПОДГРУППЕ VII ГРУППЫ ПСХЭ Д.И. МЕНДЕЛЕЕВА
- 6. ГАЛОГЕНЫ РАСПОЛОЖЕНЫ В ГЛАВНОЙ ПОДГРУППЕ VII ГРУППЫ ПСХЭ Д.И. МЕНДЕЛЕЕВА
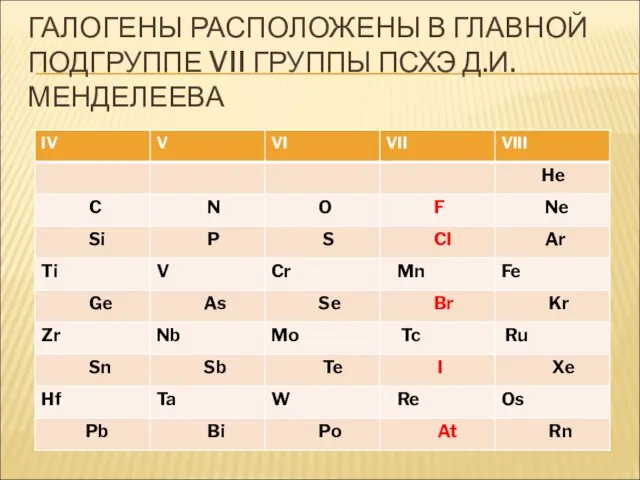
- 7. ГАЛОГЕНЫ РАСПОЛОЖЕНЫ В ГЛАВНОЙ ПОДГРУППЕ VII ГРУППЫ ПСХЭ Д.И. МЕНДЕЛЕЕВА
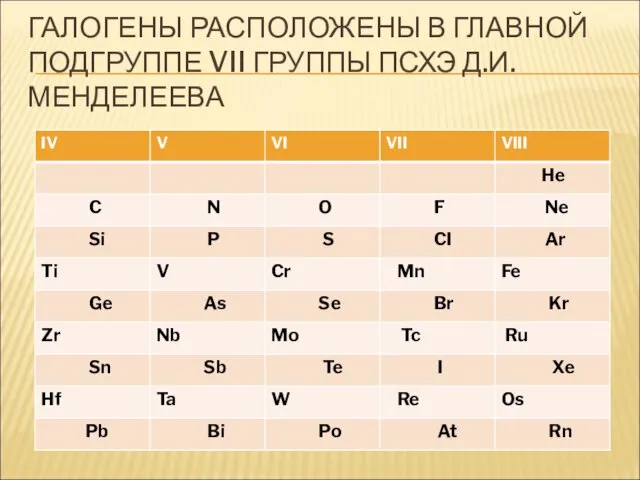
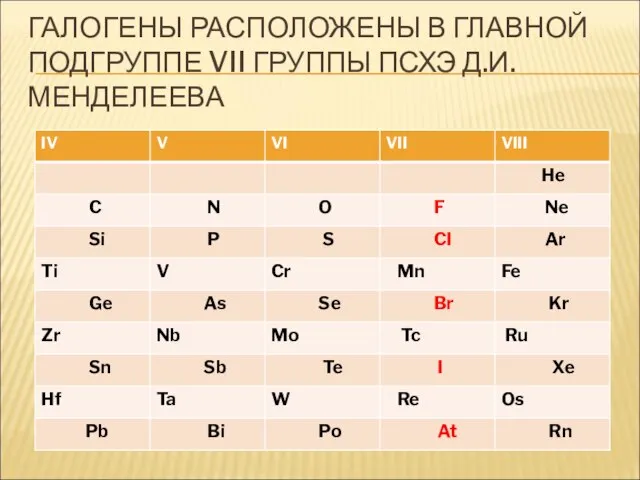
- 8. ГАЛОГЕНЫ РАСПОЛОЖЕНЫ В ГЛАВНОЙ ПОДГРУППЕ VII ГРУППЫ ПСХЭ Д.И. МЕНДЕЛЕЕВА
- 9. ГАЛОГЕНЫ «рождающие соли» F CI Br I At
- 10. РАСПРОСТРАНЕННОСТЬ ГАЛОГЕНОВ В ПРИРОДЕ
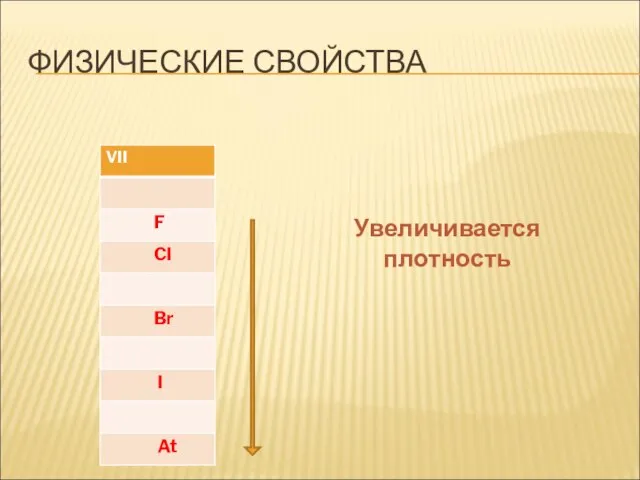
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА Увеличивается плотность
- 12. ФИЗИЧЕСКИЕ СВОЙСТВА Увеличивается плотность Повышаются температуры кипения и плавления
- 13. ФИЗИЧЕСКИЕ СВОЙСТВА Увеличивается плотность Повышаются температуры кипения и плавления Усиливается интенсивность окраски
- 14. ФТОР F2 Ядовитый газ светло- зелёного цвета
- 15. ХЛОР CI2 - Ядовитый газ жёлто-зеленого цвета
- 16. БРОМ Br2 Токсичная тяжёлая жидкость красно- бурого цвета
- 17. ЙОД I2 – Твёрдое кристаллическое вещество с металлическим блеском При нагревании образует пары фиолетового цвета
- 18. ОТВЕТЬТЕ НА ВОПРОСЫ. Число электронов на внешнем энергетическом уровне атома; Изменение радиуса атомов и окислительно-восстановительных свойств
- 19. ПРОВЕРКА: На внешнем энергетическом уровне галогены содержат 7 электронов. В главной подгруппе с увеличением зарядов ядер,
- 20. ХИМИЧЕСКИЕ СВОЙСТВА F) ) 2 7 Г°+1е = Г¯ - Галогены- окислители
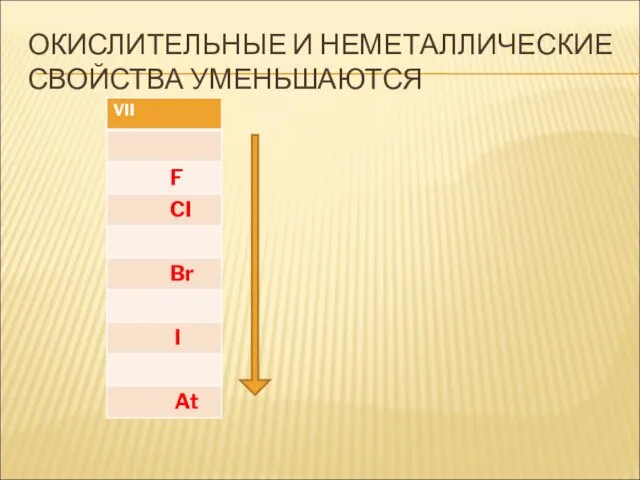
- 21. ОКИСЛИТЕЛЬНЫЕ И НЕМЕТАЛЛИЧЕСКИЕ СВОЙСТВА УМЕНЬШАЮТСЯ
- 22. БОЛЕЕ АКТИВНЫЙ ГАЛОГЕН ВЫТЕСНЯЕТ МЕНЕЕ АКТИВНЫЙ ИЗ ЕГО СОЕДИНЕНИЙ С МЕТАЛЛАМИ И ВОДОРОДОМ 2KI + Br2
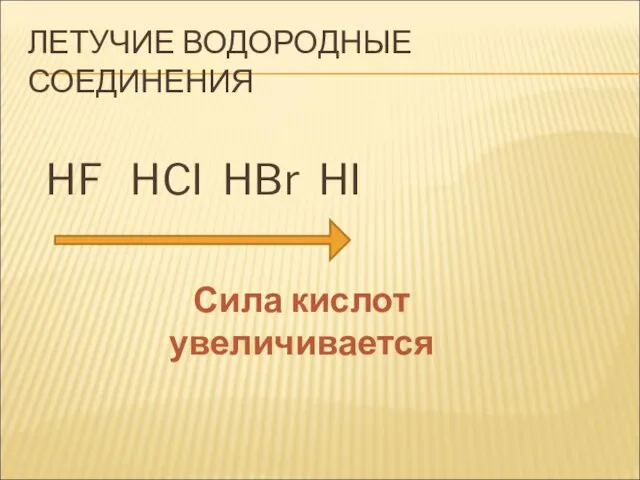
- 23. ЛЕТУЧИЕ ВОДОРОДНЫЕ СОЕДИНЕНИЯ HF HCI HBr HI Сила кислот увеличивается
- 24. Л. О. №2 ВЫТЕСНЕНИЕ ОДНИХ ГАЛОГЕНОВ ДРУГИМИ ИЗ ИХ СОЕДИНЕНИЙ ОФОРМИТЕ РЕЗУЛЬТАТЫ РАБОТЫ В ВИДЕ ТАБЛИЦЫ
- 25. Л. О. №3 РАСТВОРИМОСТЬ ЙОДА В ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ ОФОРМИТЕ РЕЗУЛЬТАТЫ РАБОТЫ В ВИДЕ ТАБЛИЦЫ Запишите уравнения
- 26. ВОПРОСЫ И ЗАДАНИЯ Перечислите галогены. Фтор, хлор, бром, йод, астат. Где в ПСХЭ располагаются галогены? в
- 27. ВОПРОСЫ И ЗАДАНИЯ Сопоставьте : Хлор красно – бурая жидкость Бром светло – зеленый газ Йод
- 28. ВОПРОСЫ И ЗАДАНИЯ Дополните: Самый сильный неметалл – фтор. Самая сильная бескислородная кислота – HI. Как
- 29. Домашнее задание § 13 , УПРАЖНЕНИЯ 1- 4 СТР. 61.
- 31. Скачать презентацию





















 Презентация на тему Йод
Презентация на тему Йод  Александрит
Александрит Вебинар. Задачи из домашек по 27-29 задачам
Вебинар. Задачи из домашек по 27-29 задачам Гидролиз солей. Какие типы гидролиза возможны?
Гидролиз солей. Какие типы гидролиза возможны? Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Растворение. Растворы. Урок в 8 классе
Растворение. Растворы. Урок в 8 классе Закономерности процессов тепло- и газообмена на пожаре
Закономерности процессов тепло- и газообмена на пожаре Предельные углеводороды
Предельные углеводороды Амины. Номенклатура
Амины. Номенклатура Галогены
Галогены Порох. Сера, халькогены
Порох. Сера, халькогены Презентация на тему Дисперсные системы
Презентация на тему Дисперсные системы  Органические соединения
Органические соединения Природные источники углеводородов
Природные источники углеводородов Алкены.Номенклатура
Алкены.Номенклатура Презентация на тему Алкины. Ацетилен
Презентация на тему Алкины. Ацетилен  Золото (Au)
Золото (Au) Цикл трикарбоновых кислот (цикл Кребса)
Цикл трикарбоновых кислот (цикл Кребса) Атомы химических элементов
Атомы химических элементов Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6
Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6 lektsia_5
lektsia_5 Реакции обмена
Реакции обмена Составление химических формул по валентности
Составление химических формул по валентности Kyseliny. Vlastnosti
Kyseliny. Vlastnosti Метил-трет-бутиловый эфир
Метил-трет-бутиловый эфир Щелочноземельные металлы
Щелочноземельные металлы Особенности структуры сплава FeCu1Si16B6 на нанометровом и морфологическом уровнях
Особенности структуры сплава FeCu1Si16B6 на нанометровом и морфологическом уровнях Правила работы и хранения щелочных металлов. Утилизация остатков щелочных металлов
Правила работы и хранения щелочных металлов. Утилизация остатков щелочных металлов