Содержание
- 2. 1. Записать молекулярное уравнение реакции Даны растворы хлорида железа(III) и гидроксида калия. Написать молекулярное и ионные
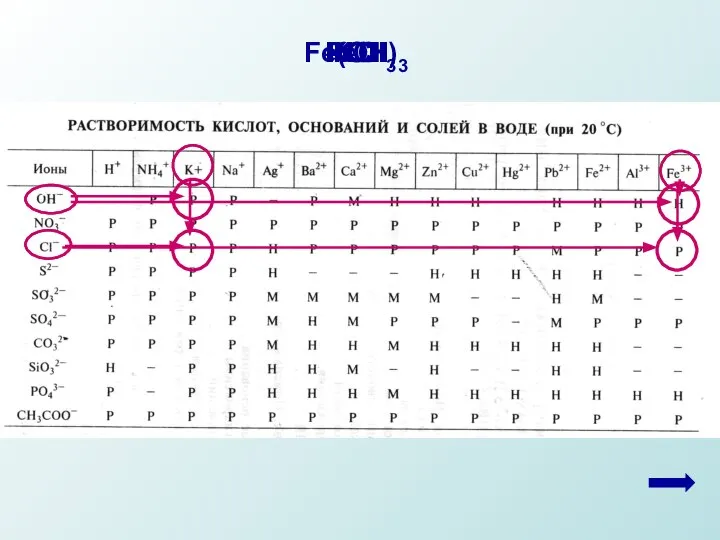
- 3. 2. Подчеркнуть формулы электролитов (формулы кислот, оснований, солей Используя таблицу растворимости определить растворимость электролитов и записать
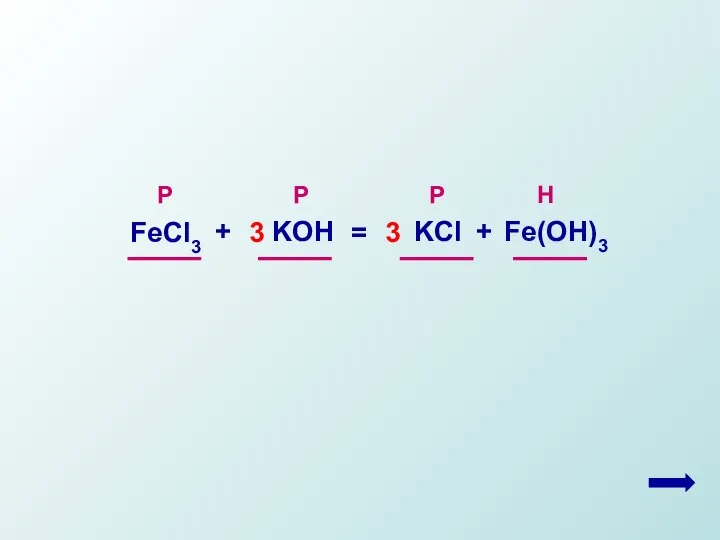
- 4. FeCl3 KOH Fe(OH)3 KCl
- 5. Р Р Р Н
- 6. 3. Написать полное ионное уравнение реакции. ЗАПОМНИТЬ!!! В ионных уравнениях формулы электролитов 1) растворимых в воде
- 8. Скачать презентацию



 Презентация на тему Химия в разных науках
Презентация на тему Химия в разных науках  Массовая доля химического элемента
Массовая доля химического элемента Лаборатория молекулярной спектроскопии и анализа
Лаборатория молекулярной спектроскопии и анализа Спирты
Спирты Виды аккумулирования энергии
Виды аккумулирования энергии Основания. Классификация оснований
Основания. Классификация оснований Химическая формула. Химия 8 класс
Химическая формула. Химия 8 класс Исследование фармакологических препаратов на хлориды, методом аргентометрии
Исследование фармакологических препаратов на хлориды, методом аргентометрии Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики Легированные стали
Легированные стали Спирты и фенолы
Спирты и фенолы Радиоактивные превращения. Закон радиоактивного распада. Период полураспада
Радиоактивные превращения. Закон радиоактивного распада. Период полураспада 8-11 2 валентность
8-11 2 валентность Вольтамперометрия. Полярография постоянного тока. Лекция 3 (ФХМА)
Вольтамперометрия. Полярография постоянного тока. Лекция 3 (ФХМА) Сухой метод определения глюкозы. Глюкометры
Сухой метод определения глюкозы. Глюкометры Строение атома
Строение атома Гидрокрекинг
Гидрокрекинг Изомерия
Изомерия Ионные уравнения
Ионные уравнения Презентация на тему Нефть. Свойства, состав, переработка
Презентация на тему Нефть. Свойства, состав, переработка  Молекулярно-кинетическая теория. Макро- и микропараметры
Молекулярно-кинетическая теория. Макро- и микропараметры Общие схемы синтеза гетероциклов
Общие схемы синтеза гетероциклов Виды каталитических ядов и способы их устранения
Виды каталитических ядов и способы их устранения Углеводы. Глюкоза
Углеводы. Глюкоза Презентация на тему Водород (8 класс)
Презентация на тему Водород (8 класс)  Оксиды, получение и свойства
Оксиды, получение и свойства Материалы в промышленности
Материалы в промышленности Кислоты, их состав и название
Кислоты, их состав и название