Содержание
- 2. Дисперсные системы Чистые вещества в природе встречаются очень редко. Смеси разных веществ в различных агрегатных состояниях
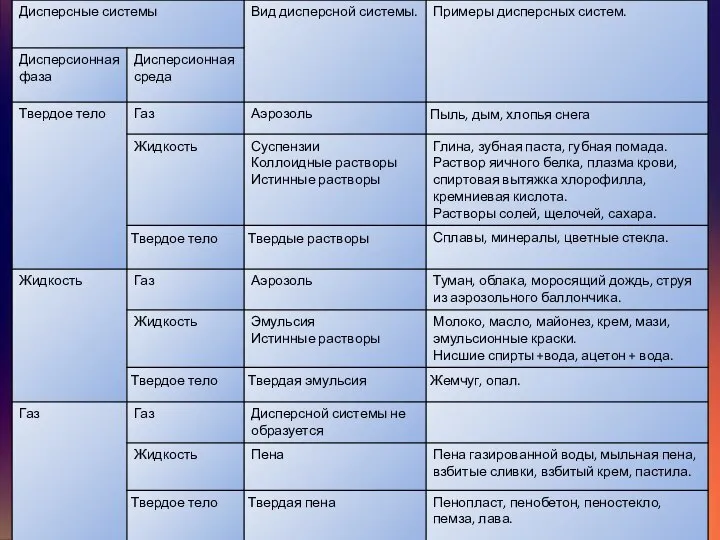
- 3. В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 9 видов таких
- 4. По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные (взвеси) с размерами частиц
- 6. Взвеси Взвеси — это дисперсные системы, в которых размер частиц фазы более 100 нм. Это непрозрачные
- 7. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пыли),
- 8. Коллоидные системы Коллоидные системы — это такие дисперсные системы, в которых размер частиц фазы от 100
- 9. 1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок — кариоплазма, содержимое
- 10. Это явление называют эффектом Тиндаля. Более крупные, чем в истинном растворе, частицы дисперсной фазы золя отражают
- 11. Коагуляция — явление слипания коллоидных частиц и выпадения их в осадок — наблюдается при нейтрализации зарядов
- 12. 2. Гели, или студни, представляющие собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое
- 13. Растворы. Раствором называют гомогенную систему, состоящую из двух и более веществ. Растворы всегда однофазны, то есть
- 15. Скачать презентацию
Слайд 2Дисперсные системы
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в
Дисперсные системы
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в

Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой. Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными (неоднородными).
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном.
Слайд 3В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно
Слайд 4По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные

Слайд 6Взвеси
Взвеси — это дисперсные системы, в которых размер частиц фазы более 100
Взвеси
Взвеси — это дисперсные системы, в которых размер частиц фазы более 100

1) эмульсии (и среда, и фаза — нерастворимые друг в друге жидкости). Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т. д.;
2) суспензии (среда — жидкость, а фаза — нерастворимое в ней твердое вещество). Это строительные растворы (например, «известковое молоко» для побелки), взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде — планктон, которым питаются гиганты-киты, и т. д.;
3) аэрозоли — взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различают пыли, дымы, туманы.
Слайд 7Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более
Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более

Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопления облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, распыление топлив, выработка сухих молочных продуктов, лечение дыхательных путей (ингаляция) — примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли — туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Слайд 8Коллоидные системы
Коллоидные системы — это такие дисперсные системы, в которых размер частиц
Коллоидные системы
Коллоидные системы — это такие дисперсные системы, в которых размер частиц

Их подразделяют на золи (коллоидные растворы) и гели (студни).
Слайд 91. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный

Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия («растворимого стекла») с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (Ш) в горячей воде. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся «светящейся дорожке» — конусу при пропускании через них луча света.
Слайд 10Это явление называют эффектом Тиндаля. Более крупные, чем в истинном растворе, частицы
Это явление называют эффектом Тиндаля. Более крупные, чем в истинном растворе, частицы

Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Но при определенных условиях может происходить процесс коагуляции.
Слайд 11Коагуляция — явление слипания коллоидных частиц и выпадения их в осадок —
Коагуляция — явление слипания коллоидных частиц и выпадения их в осадок —

Слайд 122. Гели, или студни, представляющие собой студенистые осадки, образующиеся при коагуляции золей.
2. Гели, или студни, представляющие собой студенистые осадки, образующиеся при коагуляции золей.

Слайд 13Растворы.
Раствором называют гомогенную систему, состоящую из двух и более веществ.
Растворы всегда однофазны,
Растворы.
Раствором называют гомогенную систему, состоящую из двух и более веществ.
Растворы всегда однофазны,

Растворы называют истинными, если требуется подчеркнуть их отличие от коллоидных растворов.
Растворителем считают то вещество, агрегатное состояние которого не изменяется при образовании раствора. Например, вода в водных растворах поваренной соли, сахара, углекислого газа. Если же раствор образовался при смешении газа с газом, жидкости с жидкостью и твердого вещества с твердым, растворителем считают тот компонент, которого больше в растворе. Так, воздух — это раствор кислорода, благородных газов, углекислого газа в азоте (растворитель). Столовый уксус, в котором содержится от 5 до 9% уксусной кислоты, представляет собой раствор этой кислоты в воде (растворитель — вода). Но в уксусной эссенции роль растворителя играет уксусная кислота, так как ее массовая доля составляет 70— 80%, следовательно, это раствор воды в уксусной кислоте.
 Химические свойства амфотерных оксидов и гидроксидов
Химические свойства амфотерных оксидов и гидроксидов Презентация на тему Электролиз: что полезно знать
Презентация на тему Электролиз: что полезно знать  Халькогены. Способность к катенации
Халькогены. Способность к катенации Урок-путешествие по теме «Первоначальные химические понятия»
Урок-путешествие по теме «Первоначальные химические понятия» Относительная атомная масса Урок 8 класс Учитель химии Чиркунова Л.А.
Относительная атомная масса Урок 8 класс Учитель химии Чиркунова Л.А. Резиновые материалы и клеи. Тема 7.5
Резиновые материалы и клеи. Тема 7.5 Свойства жидкостей
Свойства жидкостей Азот и его соединения
Азот и его соединения Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Алкины и их свойства
Алкины и их свойства Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов
Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов Презентация на тему Глюкоза (10 класс)
Презентация на тему Глюкоза (10 класс)  Производство метанола
Производство метанола Презентация на тему Химическая промышленность мира
Презентация на тему Химическая промышленность мира  Занимательная химия Программу составил
Занимательная химия Программу составил  Составление ионных уравнений
Составление ионных уравнений Химическая связь в комплексных соединениях
Химическая связь в комплексных соединениях Презентация на тему Железо 9 класс
Презентация на тему Железо 9 класс  Презентация на тему Классификация химических реакций 11 класс
Презентация на тему Классификация химических реакций 11 класс  Промышленный метод получения ацетилена
Промышленный метод получения ацетилена Презентация на тему Основные понятия химии
Презентация на тему Основные понятия химии  Взаимодействие молекул (7 класс)
Взаимодействие молекул (7 класс) Актиний. Нахождение в природе
Актиний. Нахождение в природе Хим_10_30_Производство_аммиака
Хим_10_30_Производство_аммиака Показатель активности водородных ионов. Лабораторная работа №4
Показатель активности водородных ионов. Лабораторная работа №4 Проверочный тест. Номенклатура алканов
Проверочный тест. Номенклатура алканов Презентация на тему Количество вещества
Презентация на тему Количество вещества  Неметаллы азот
Неметаллы азот