Содержание
- 2. Под химической связью понимаются электрические силы притяжения, удерживающие частицы друг около друга. Частицами могут быть атомы,
- 3. Причина образования химической связи — стремление атомов посредством взаимодействия с другими атомами достичь более устойчивого состояния.
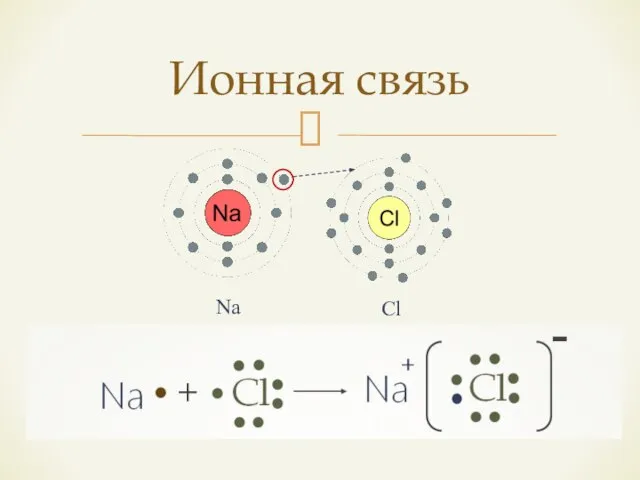
- 4. Ионная связь Na Cl
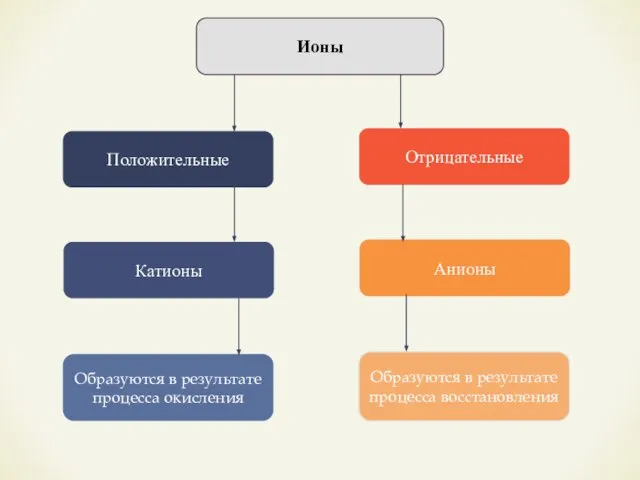
- 5. Ионы Положительные Отрицательные Катионы Образуются в результате процесса окисления Анионы Образуются в результате процесса восстановления
- 6. Как правило, ионная связь возникает между атомами типичных металлов и типичных неметаллов.
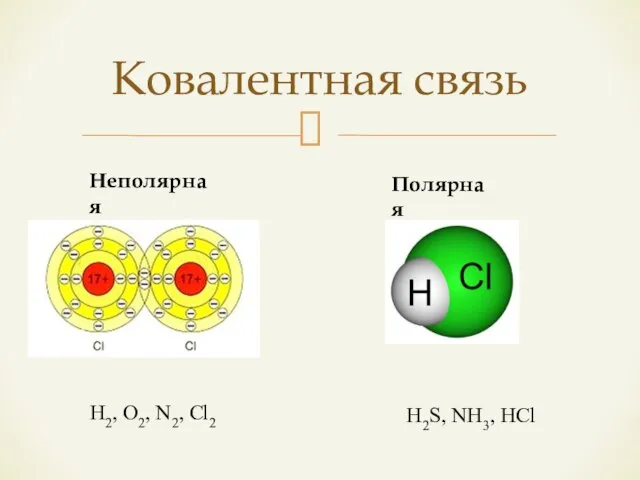
- 7. Ковалентная связь Неполярная Полярная H2, O2, N2, Cl2 H2S, NH3, HCl
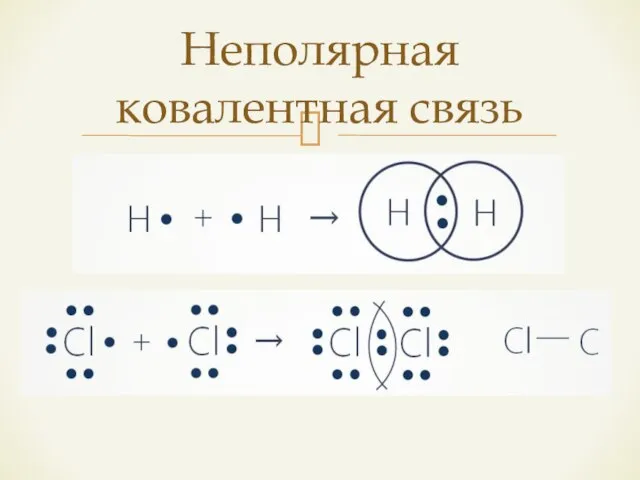
- 8. Неполярная ковалентная связь
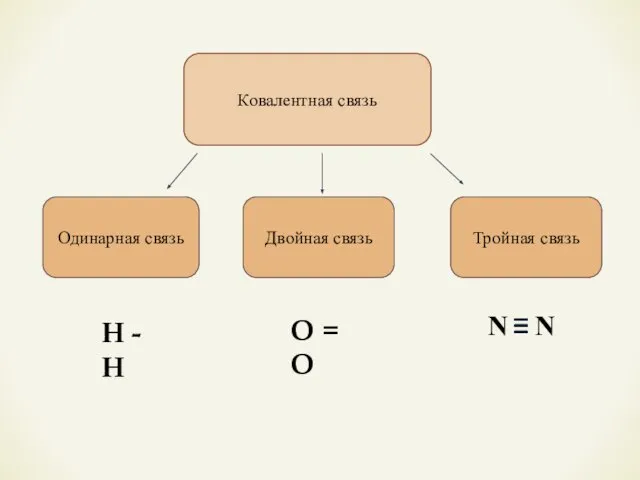
- 9. Ковалентная связь Одинарная связь Двойная связь Тройная связь О = О Н - Н
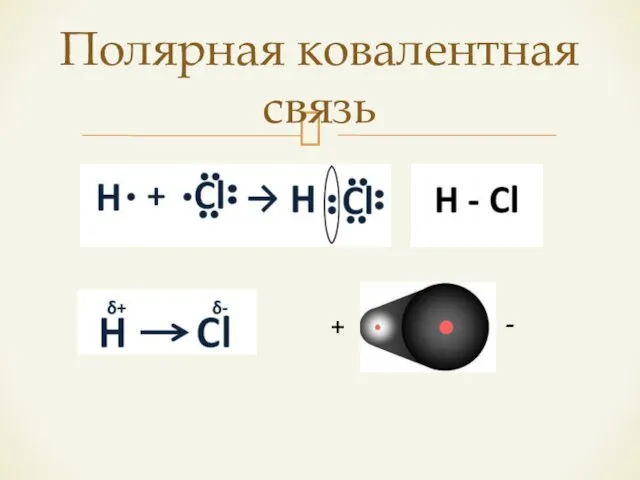
- 10. Полярная ковалентная связь + -
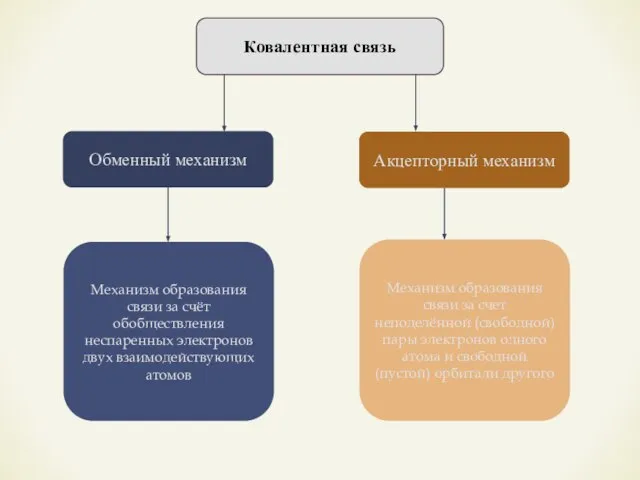
- 11. Ковалентная связь Обменный механизм Акцепторный механизм Механизм образования связи за счёт обобществления неспаренных электронов двух взаимодействующих
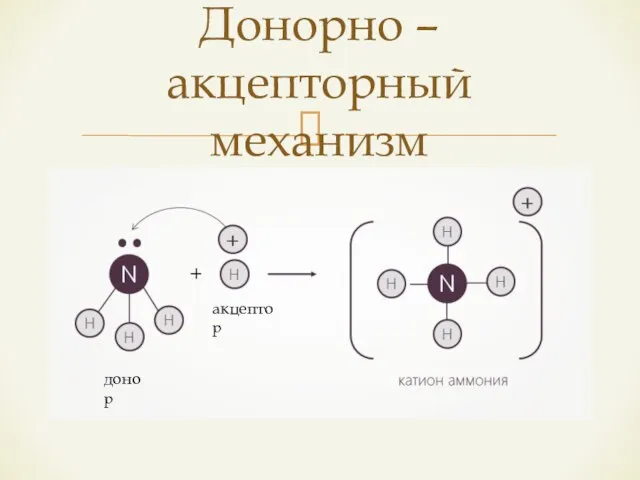
- 12. Донорно – акцепторный механизм донор акцептор
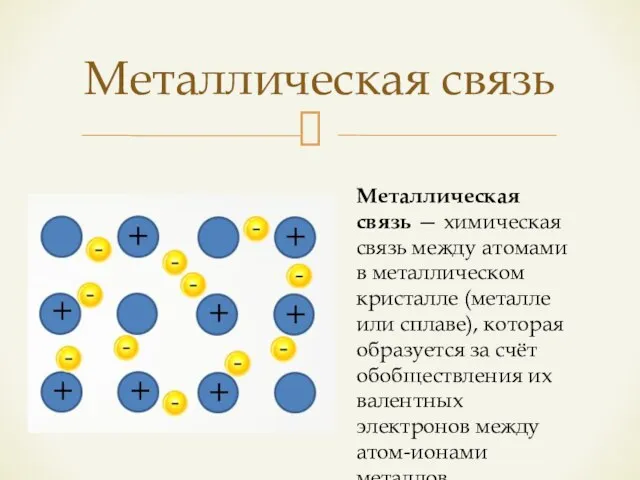
- 13. Металлическая связь Металлическая связь — химическая связь между атомами в металлическом кристалле (металле или сплаве), которая
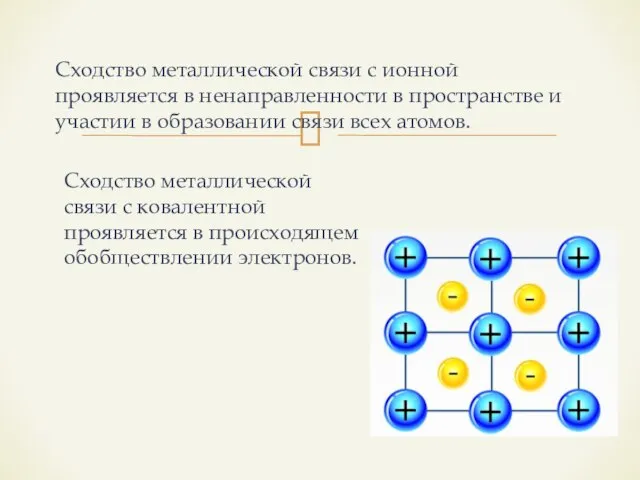
- 14. Сходство металлической связи с ионной проявляется в ненаправленности в пространстве и участии в образовании связи всех
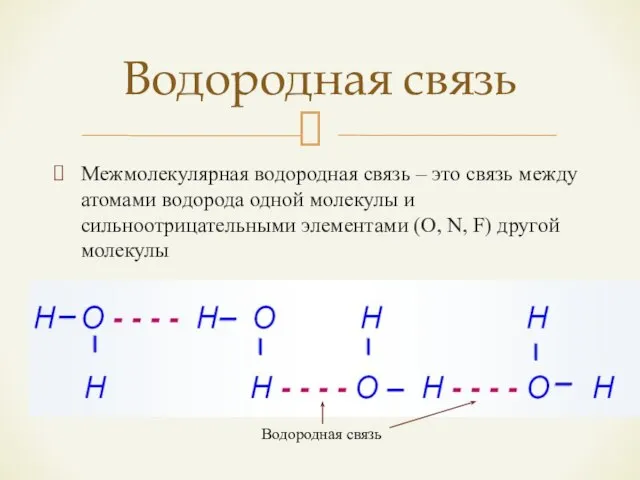
- 15. Межмолекулярная водородная связь – это связь между атомами водорода одной молекулы и сильноотрицательными элементами (O, N,
- 17. Скачать презентацию



 Комплексное задание по дисциплине основы материаловедения для группы 18
Комплексное задание по дисциплине основы материаловедения для группы 18 Презентация на тему Ионы и ионная химическая связь
Презентация на тему Ионы и ионная химическая связь  Синтез 7,7 - дихлоробицикло [4.1.0] гептана
Синтез 7,7 - дихлоробицикло [4.1.0] гептана Неметаллы. Особенности электронного строения атомов НМ
Неметаллы. Особенности электронного строения атомов НМ Металлы 1 А - группы. Щелочные металлы
Металлы 1 А - группы. Щелочные металлы Сернистый ангидрид SO2. Диоксид серы
Сернистый ангидрид SO2. Диоксид серы Применение солей
Применение солей Презентация на тему Артур Конан-Дойл «Собака Баскервилей»
Презентация на тему Артур Конан-Дойл «Собака Баскервилей»  Производство серной кислоты
Производство серной кислоты Чистые вещества и смеси. Классификация веществ. Оксиды
Чистые вещества и смеси. Классификация веществ. Оксиды Алканы. Химические совйства
Алканы. Химические совйства Изготовление слайма в домашних условиях
Изготовление слайма в домашних условиях Учебник системы учебно-методических комплектов Алгоритм успеха
Учебник системы учебно-методических комплектов Алгоритм успеха Обобщение знаний об углеводородах
Обобщение знаний об углеводородах Строение металлов и их сплавов
Строение металлов и их сплавов Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Молярный объем газов
Молярный объем газов Презентация на тему Виды химической связи и типы кристаллических решеток
Презентация на тему Виды химической связи и типы кристаллических решеток  Основные сведения о металлах и сплавах и их свойства
Основные сведения о металлах и сплавах и их свойства Растворение +СО2 + в +Н2О. Агрегатное состояние вещества
Растворение +СО2 + в +Н2О. Агрегатное состояние вещества Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Углеводы: моно-, олиго- и полисахариды
Углеводы: моно-, олиго- и полисахариды Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері
Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері Решение задач по органической химии
Решение задач по органической химии Именем Менделеева Д.И названы
Именем Менделеева Д.И названы Атом
Атом Подготовка к контрольной работе Неметаллы
Подготовка к контрольной работе Неметаллы Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста
Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста