96%-ным (по массе) раствором этанола в воде (V = 100 мл, плотность ρ = 0,8 г/мл).
Решение:
m(раствора) = V х ρ
m (раствора) = 100 мл х 0,8 г/мл = 80 г
m(C2H5OH) = (m (раствора) х W) : 100% = 80 г х 0,96 = 76,8 г
ν(C2H5OH) = m(C2H5OH) / M(C2H5OH) = 76,84 г : 46 г/моль = 1,67 моль
Поскольку заданное количество натрия составляло 2 моль, натрий присутствует в избытке.
Поэтому объем выделенного водорода будет определяться количеством этанола:
ν1(H2) = 1/2 ν(C2H5OH) = 1/2 х 1,67 моль = 0,835 моль
V1(H2) = ν1(H2) х VM = 0,835 моль х 22,4 л/моль = 18,7 л
Вода, содержащаяся в растворе спирта, тоже реагирует с натрием с выделением водорода.
m(H2O) = (m(раствора) х W) : 100% = 80 г х 0,04 = 3,2 г
n(H2O) = m(H2O)/M(H2O) = 3,2 г : 18 г/моль = 0,178 моль
Количество натрия, оставшееся неизрасходованным после реакции с этанолом, составит:
ν(Na, остаток) = 2 моль - 1,67 моль = 0,33 моль
Таким образом, и по сравнению с заданным количеством воды (0,178 моль) натрий все равно оказывается в избытке.
Найдем количество и объем водорода, выделившегося по реакции:
ν 2(H2) = 1/2 ν(H2O) = 1/2 х 0,178 моль = 0,089 моль
V2(H2) = ν 2(H2) х VM = 0,089 моль х 22,4 л/моль = 1,99 л
Общий объем водорода: V(H2) = V1(H2) + V2(H2) = 18,7 л+ 1,99 л = 20,69 л
Ответ: V(H2) = 20,69 л.













 Водород в природе. Получение водорода и его физические свойства. 8 класс
Водород в природе. Получение водорода и его физические свойства. 8 класс Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Хлор
Хлор Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В.
Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В. Оливины. Структура оливинов
Оливины. Структура оливинов Кислота
Кислота Обобщение по теме Теория химического строения органических веществ
Обобщение по теме Теория химического строения органических веществ Физические и химические свойства алкенов
Физические и химические свойства алкенов Элемент первой группы, калий
Элемент первой группы, калий Кристаллы. Формирование кристаллов
Кристаллы. Формирование кристаллов Щелочноземельные металлы
Щелочноземельные металлы Пространственная изомерия органических соединений
Пространственная изомерия органических соединений Щелочно-земельные металлы и магний
Щелочно-земельные металлы и магний Презентация на тему Химические свойства и применение алканов
Презентация на тему Химические свойства и применение алканов  Реакции соединения и разложения
Реакции соединения и разложения Конспект по химии
Конспект по химии Комбинаторика в химии
Комбинаторика в химии Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Железо и его соединения
Железо и его соединения Электролитическая диссоциация
Электролитическая диссоциация Вымораживание воды
Вымораживание воды Своя игра. Химические элементы
Своя игра. Химические элементы Химические вещества парабены
Химические вещества парабены Классификация спиртов. Изомерия спиртов
Классификация спиртов. Изомерия спиртов Фенолы. Классификация
Фенолы. Классификация Строение атома. Химическая связь
Строение атома. Химическая связь Алкадиены. Строение. свойства и применение
Алкадиены. Строение. свойства и применение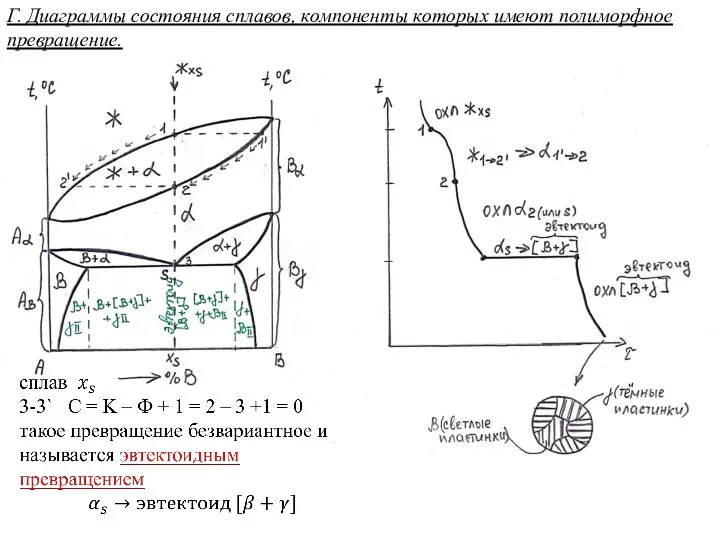 Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение
Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение