Слайд 2Содержание
Химические элементы: металлы и неметаллы.
Характерные признаки металлов.
Строение металлов.
Свойства

неметаллов.
Металлы и сплавы.
Черные и цветные металлы.
Внутреннее строение металлов и сплавов. Аморфное и кристаллическое строение.
Типы кристаллических решеток.
Особенности металлов как тел, имеющих кристаллическое строение.
Анизотропия свойств.
Слайд 3Химические элементы: металлы и неметаллы.
Мир по своей природе материален. Все, что нас

окружает, называется материей.
Каждый вид отдельный материи, обладающий определенными составом и свойствами называется веществом. Признаки, по которым различные вещества отличаются одно от другого, называются свойствами (цвет, агрегатное состояние, плотность…).
Вещества могут быть простыми и сложными:
простые вещества (железо, медь, кислород, углерод…) состоят из атомов или ионов одного элемента;
сложные вещества (вода, серная кислота, сталь…) состоят из молекул, образованных атомами или ионами разных элементов.
Вещества могут быть чистыми или находиться в виде смесей:
чистые вещества (простые и сложные) состоят из однородных молекул, атомов и ионов;
смеси состоят из различных простых и сложных веществ.
Слайд 4Все химические элементы делятся на металлы и неметаллы (из 110 элементов 86

металлы).
Металлы -- простые вещества, обладающие свободными, не связанными с определенными атомами электронами, которые способны перемещаться по всему объему тела. Этим определяются свойства металлов. Атомы металлов легко отдают внешние (валентные) электроны.
Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств:
«металлический блеск» (хорошая отражательная способность);
пластичность;
высокая теплопроводность;
высокая электропроводность;
возрастание электросопротивления с возрастанием температуры.
Алюминий, железо, кальций, натрий, калий, магний и титан – наиболее распространенные металлы.
В технике металлами называются все металлические материалы. К ним относятся простые и сложные металлы (сплавы).
Слайд 5Неметаллы, как правило, хрупки,
лишены металлического блеска, имеют низкую тепло- и электропроводность.
Электросопротивление неметаллов

с повышением температуры понижается.
При химических реакциях атомы неметаллов, стремясь заполнить внешнюю оболочку, присоединяют электроны и заряжаются отрицательно.
В промышленности из неметаллов широко применяются кислород, углерод, водород и другие элементы.
Слайд 6Все применяемые в технике металлы делятся на черные и цветные.
К черным металлам

относятся железо и его сплавы (сталь и чугун) Все остальные металлы и сплавы составляют группу цветных металлов.
Слайд 9Внутреннее строение металлов и сплавов
Все твердые тела делятся на аморфные и кристаллические.
В

аморфных телах атомы расположены хаотично, т. е. в беспорядке, без всякой системы. Примерами аморфных тел могут служить стекло, клей, воск, канифоль и др.
В кристаллических телах атомы расположены в строго определенном порядке,
Все металлы и сплавы имеют кристаллическое строение. К кристаллическим телам относятся также поваренная соль, кварц, сахарный песок и др.
Основным признаком металлов как кристаллических тел является их правильное внутреннее строение. Если атомы металла мысленно соединить прямыми линиями, то получится правильная геометрическая система, называемая пространственной кристаллической решеткой.
Из кристаллической решетки можно выделить элементарную кристаллическую ячейку, представляющую наименьший комплекс атомов, повторением которого в трех измерениях можно построить всю решетку.
Слайд 10Порядок расположения атомов в кристаллических решетках может быть различным. Наиболее распространены три
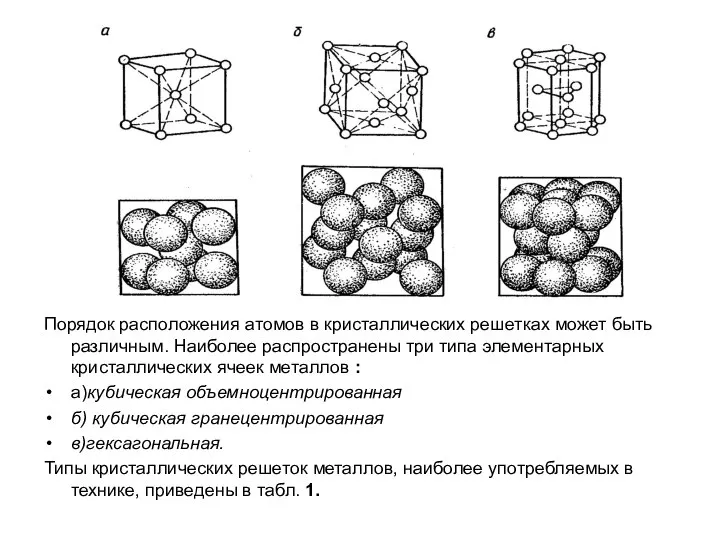
типа элементарных кристаллических ячеек металлов :
а)кубическая объемноцентрированная
б) кубическая гранецентрированная
в)гексагональная.
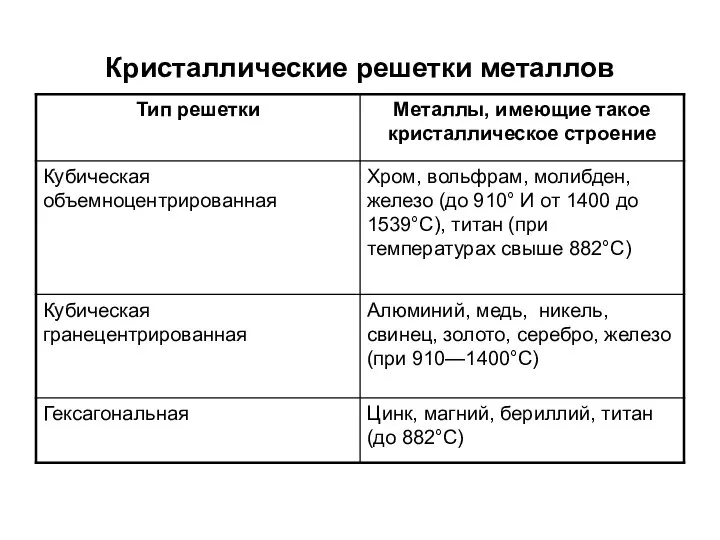
Типы кристаллических решеток металлов, наиболее употребляемых в технике, приведены в табл. 1.
Слайд 11Кристаллические решетки металлов
Слайд 12Особенности металлов как тел, имеющих кристаллическое строение
Характерные признаки металлов обусловлены их внутренним

строением, т. е. структурой. Геометрическая правильность расположения атомов в кристаллических решетках придает металлам особенности, которых нет у аморфных тел.
Первой особенностью металлов является анизотропия свойств кристаллов, т. е. различие свойств кристаллов в разных направлениях. Анизотропия объясняется неодинаковой плотностью атомов в разных плоскостях кристаллической решетки, так как расстояния между атомами в решетках в разных направлениях неодинаковы.
В отличие от кристаллических тел аморфные тела изотропны, т. е. их свойства не зависят от направления.
У металлических тел анизотропия свойств не выражена так резко, как у отдельных кристаллов. Металлы являются поликристаллическими телами, т. е. они состоят не из одного, а из бесчисленного множества кристаллов, по-разному ориентированных.
Слайд 13Второй особенностью металлов как тел кристаллического строения является наличие у них плоскостей

скольжения (спайности). По этим плоскостям происходит сдвиг или отрыв (разрушение) частиц кристаллов под действием внешних усилий. У аморфных тел смещение частиц происходит не по определенным плоскостям, а беспорядочно. Излом аморфного тела всегда имеет неправильную, искривленную форму.
Третьей особенностью металлов как тел кристаллического строения является то, что процесс перехода их из твердого состояния в жидкое и наоборот происходит при определенной температуре, называемой температурой плавления (затвердевания).
Аморфные тела переходят в жидкое состояние постепенно и не имеют определенной температуры плавления.












 Витамины. Классификация витаминов
Витамины. Классификация витаминов Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс  Тренажёр: знаки химических элементов
Тренажёр: знаки химических элементов Тема: Неметаллы
Тема: Неметаллы Алкадиены. Каучук. История открытия каучука
Алкадиены. Каучук. История открытия каучука Катаболизм пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов Исследовательский проект. Анализ состава соков разных производителей
Исследовательский проект. Анализ состава соков разных производителей Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР
Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР Физико-химические методы получения порошков металлов
Физико-химические методы получения порошков металлов Массовая доля выхода продукта реакции от теоретически возможного
Массовая доля выхода продукта реакции от теоретически возможного Разнообразие азотсодержащих органических веществ
Разнообразие азотсодержащих органических веществ Химия и искусство: техника офорт
Химия и искусство: техника офорт Окситоцин. Сила любви и биология
Окситоцин. Сила любви и биология Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Свойство металлов и сплавов
Свойство металлов и сплавов Валентность
Валентность Соли аммония
Соли аммония Количество вещества. Моль
Количество вещества. Моль Презентация по Химии "Алмаз"
Презентация по Химии "Алмаз"  Углеводороды. Природный газ. Алканы
Углеводороды. Природный газ. Алканы Рука руку моет. Механизм двух реакций
Рука руку моет. Механизм двух реакций 14257fc50bc406ef33f49ad14aa3f48b
14257fc50bc406ef33f49ad14aa3f48b Углеводы. Общее понятие углеводов
Углеводы. Общее понятие углеводов Физика Доклад
Физика Доклад Молочная кислота
Молочная кислота Белки
Белки Презентация на тему Классы неорганических веществ. Электролитическая диссоциация
Презентация на тему Классы неорганических веществ. Электролитическая диссоциация  Углеродистые конструкционные стали
Углеродистые конструкционные стали