Содержание
- 2. Что вы знаете о воде?
- 3. Вода входит в состав комет, большинства планет Солнечной системы и их спутников. На Земле вода входит
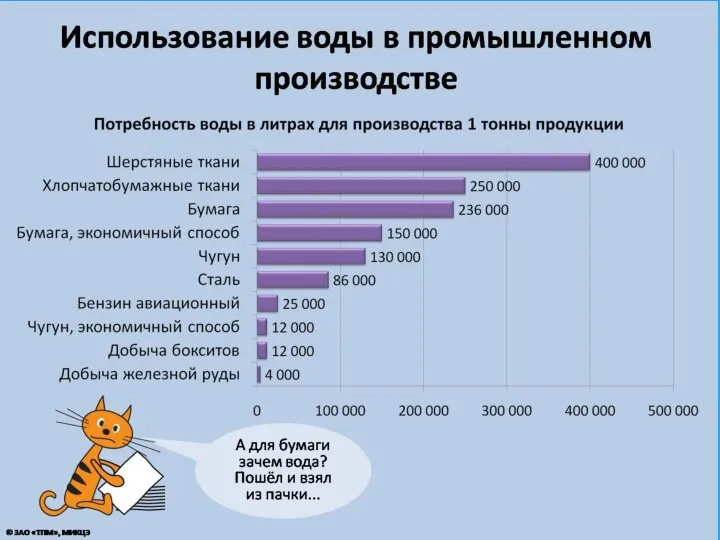
- 5. Факты о воде Из всей массы присутствующей на планете воды нормальной питьевой можно считать только 3%.
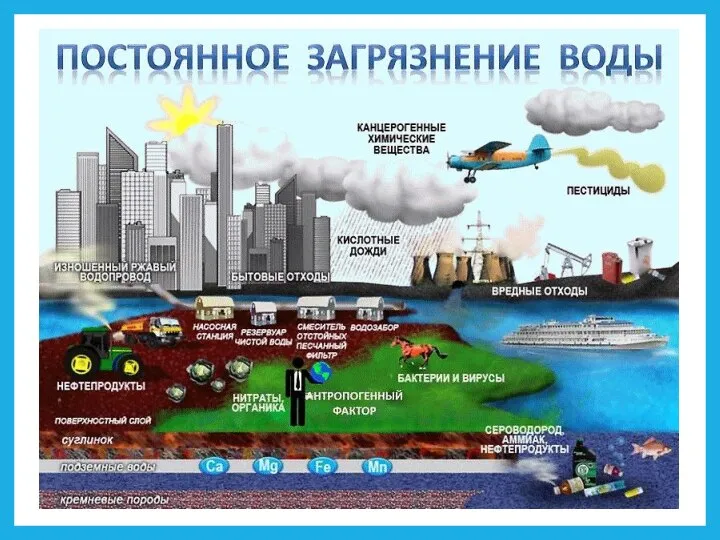
- 6. Влагооборот – это обмен водой в её различных фазовых состояниях между гидросферой, атмосферой и живыми организмами.
- 9. M(H2O) = 18,016 а.е.м. 11,19 % 88,81 % Лавуазье 1783 г. 16О, 17О, 18О Искусственно получены
- 10. Электролиз воды Pt
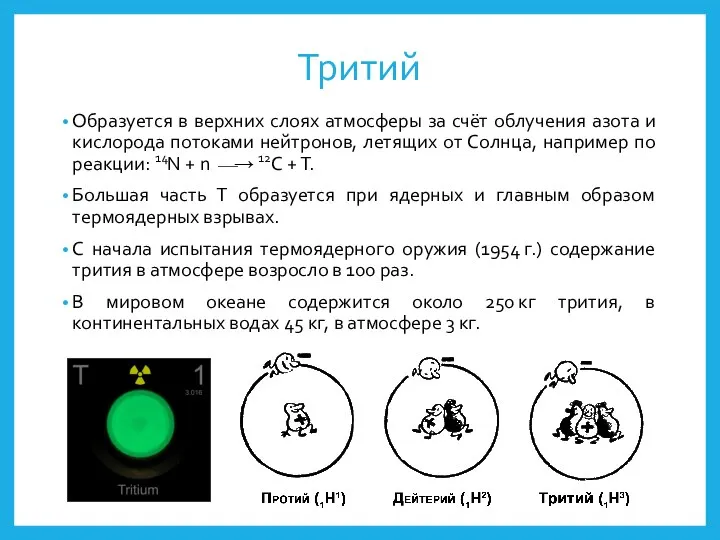
- 11. Тритий Образуется в верхних слоях атмосферы за счёт облучения азота и кислорода потоками нейтронов, летящих от
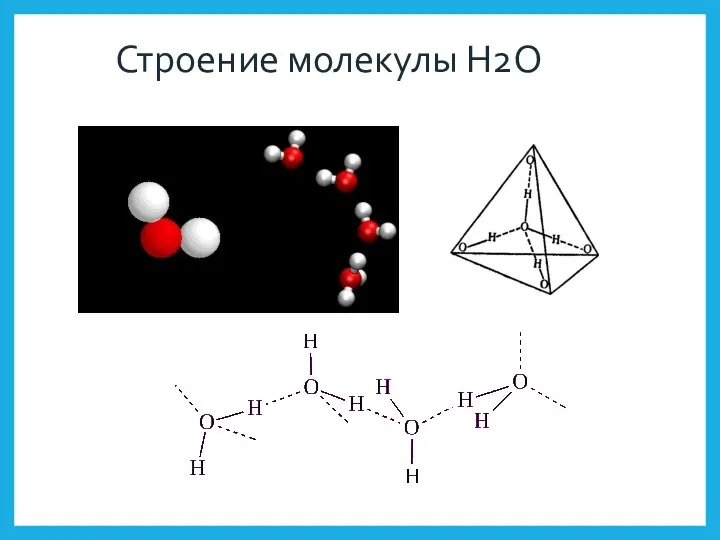
- 12. Строение молекулы H2O
- 13. Лёд образует 15 (!) кристаллических модификаций и 3 аморфных. а) Ih б) Ic в) III Густав
- 14. Ганимед, Каллисто VI, V, III, I Лёд в космосе
- 15. Влияние физ. воздействий на структуру воды
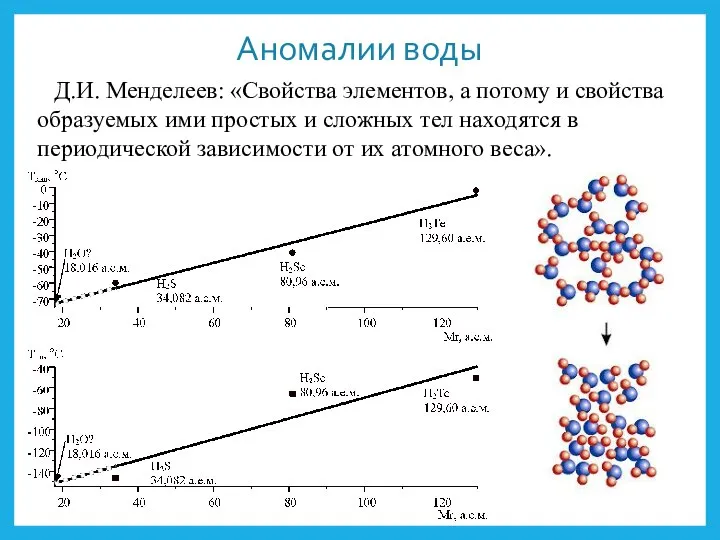
- 16. Аномалии воды Д.И. Менделеев: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел
- 17. Плотность
- 18. Основные химические свойства 2H2O ↔ 2H2+O2 H2O → Н+ и ОН- H2O + Cl2 ↔ HCl
- 20. Скачать презентацию












 Аминоксилоты. Общая формула аминокислот
Аминоксилоты. Общая формула аминокислот Характеристика кислорода и серы
Характеристика кислорода и серы Презентация в 8 классе к уроку по химии на тему__
Презентация в 8 классе к уроку по химии на тему__ Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Обобщение свойств углеводородов
Обобщение свойств углеводородов user_file_562b6f7f7ae4e
user_file_562b6f7f7ae4e Мезомерный эффект
Мезомерный эффект Теоретические основы органической химии
Теоретические основы органической химии Презентация на тему Молярный объем
Презентация на тему Молярный объем  Изучение пенопласта
Изучение пенопласта Электролитическая диссоциация. Устойчивость комплексных соединений
Электролитическая диссоциация. Устойчивость комплексных соединений Кислоты, соли
Кислоты, соли Презентация по Химии "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»"
Презентация по Химии "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»"  Свойства аренов
Свойства аренов Углеводороды
Углеводороды Презентация на тему Водород (9 класс)
Презентация на тему Водород (9 класс)  Способы получения металлов
Способы получения металлов Хром. Элемент vi группы
Хром. Элемент vi группы Контрольная работа №1
Контрольная работа №1 Алюминий
Алюминий Кислород. Нахождение в природе. Свойства. 8 класс
Кислород. Нахождение в природе. Свойства. 8 класс Стехиометрические законы химии
Стехиометрические законы химии Классификация неорганических веществ
Классификация неорганических веществ Обратимые и необратимые химические реакции. Химическое равновесие
Обратимые и необратимые химические реакции. Химическое равновесие Неметаллические материалы
Неметаллические материалы Предмет органической химии. Особенности органических веществ
Предмет органической химии. Особенности органических веществ Лекция 10. Неорганическая химия. Сероводород
Лекция 10. Неорганическая химия. Сероводород Синтез латексов
Синтез латексов