Слайд 2Джозеф Пристли
Антуан Лоран Лавуазье
Карл Вильгельм Шееле
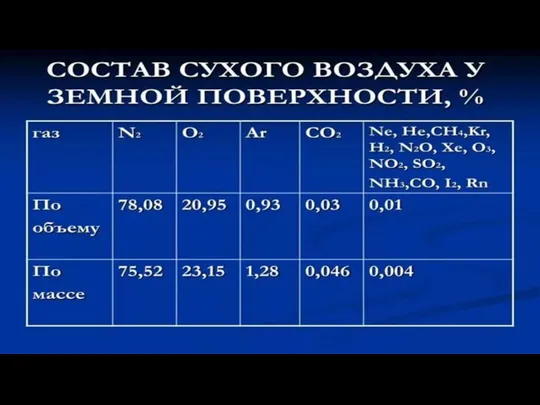
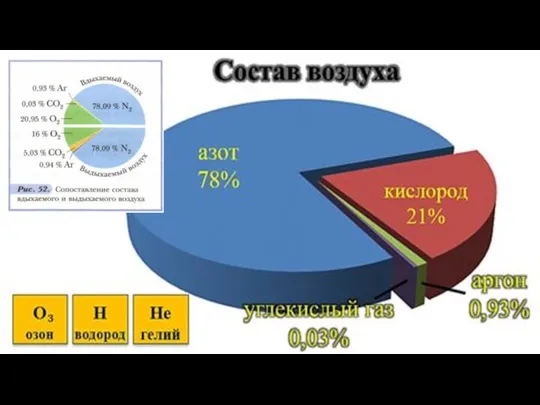
В конце XVII века установили, что воздух

– смесь газов,
в основном, азота и кислорода.
Слайд 5Плотность газов при н.у.
ρ = m = ν*M
V ν*Vm

ρ = М (г/моль) г
Vm (л/моль) л
ρ (О2) = 32 г/моль = 1,43 г/л
22,4 л/моль
ρ (СО2) = 44 г/моль = 1,96 г/л
22,4 л/моль
Слайд 6Относительная плотность газов
D = Мr1 = М1 = ρ1
Мr2 М2 ρ2
D

– безразмерная величина
D( Н2)(О2) = Мr (О2) = 32 =16
Мr (Н2) 2
Слайд 7
D( Н2)(О2) = ρ(О2) = 1,43 г/л =16
ρ(Н2) 0,09 г/л
D( Возд.)(СО2)

= Мr (СО2) = 44 =1,5
Мr (Возд.) 29




 HCl - кислота
HCl - кислота Декоративная краска с эффектом окисленной меди
Декоративная краска с эффектом окисленной меди Окислительно-восстановительные реакции. Метод электронного баланса
Окислительно-восстановительные реакции. Метод электронного баланса Основы химической термодинамики
Основы химической термодинамики Биосинтез пиримидиновых нуклеотидов
Биосинтез пиримидиновых нуклеотидов Металлическая химическая связь
Металлическая химическая связь Органическая химия. Введение
Органическая химия. Введение Кислоты, основания и соли как электролиты
Кислоты, основания и соли как электролиты Молярная масса вещества
Молярная масса вещества Основания как электролиты
Основания как электролиты Номенклатура органических соединений. Упражнения
Номенклатура органических соединений. Упражнения Углеводороды: соединения, состоящие из углерода и водорода
Углеводороды: соединения, состоящие из углерода и водорода Презентация на тему Генетическая связь между классами неорганических веществ
Презентация на тему Генетическая связь между классами неорганических веществ  Сплавы металлов
Сплавы металлов Углеводороды
Углеводороды Pomalé a rýchle reakcie v bežnom živote
Pomalé a rýchle reakcie v bežnom živote Тренажёр: знаки химических элементов
Тренажёр: знаки химических элементов Серная кислота
Серная кислота ОВР
ОВР Оксиды. Физические свойства
Оксиды. Физические свойства Svins. Iegūšana
Svins. Iegūšana Основания
Основания Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы Важнейшие породообразующие минералы
Важнейшие породообразующие минералы Влияние давления на скорость химических реакций с участием газов
Влияние давления на скорость химических реакций с участием газов Вероятность протекания химических реакций
Вероятность протекания химических реакций Метод проектов: организация деятельности по химии
Метод проектов: организация деятельности по химии Металлы. Физические свойства металлов
Металлы. Физические свойства металлов