Содержание
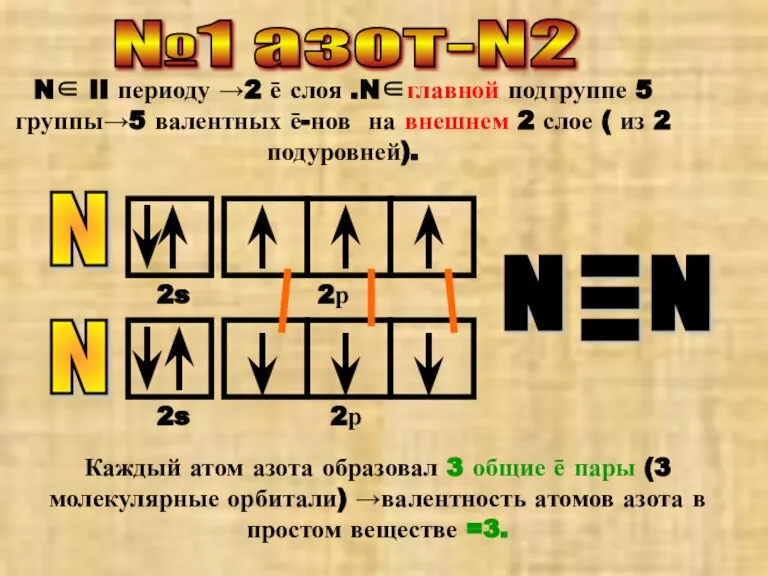
- 2. №1 азот-N2 N∈ II периоду →2 ē слоя .N∈главной подгруппе 5 группы→5 валентных ē-нов на внешнем
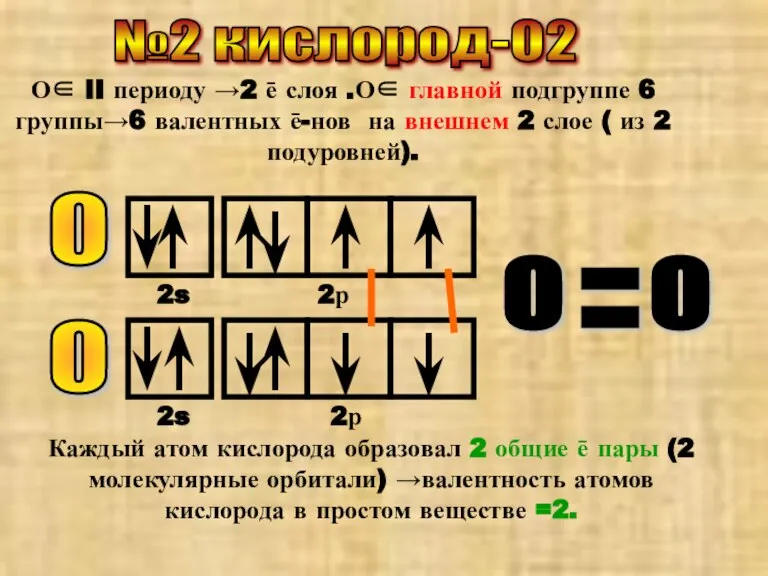
- 3. №2 кислород-О2 О∈ II периоду →2 ē слоя .О∈ главной подгруппе 6 группы→6 валентных ē-нов на
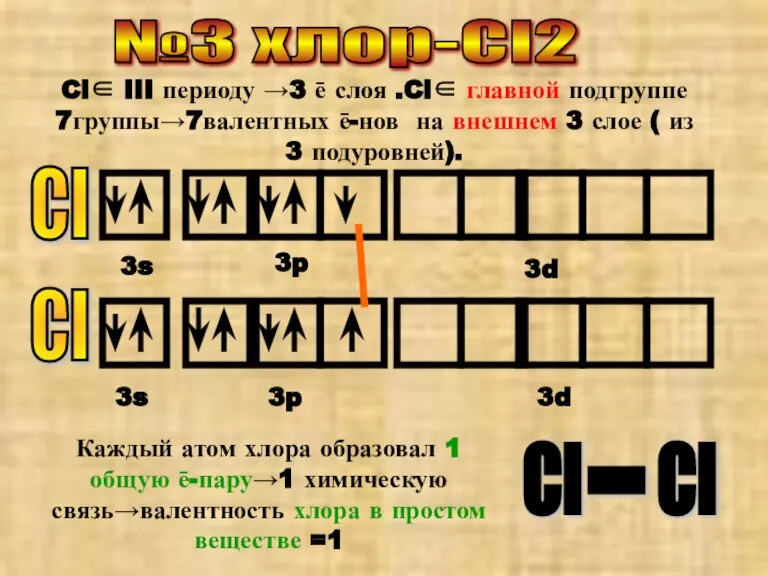
- 4. №3 хлор-Cl2 Cl Cl∈ III периоду →3 ē слоя .Cl∈ главной подгруппе 7группы→7валентных ē-нов на внешнем
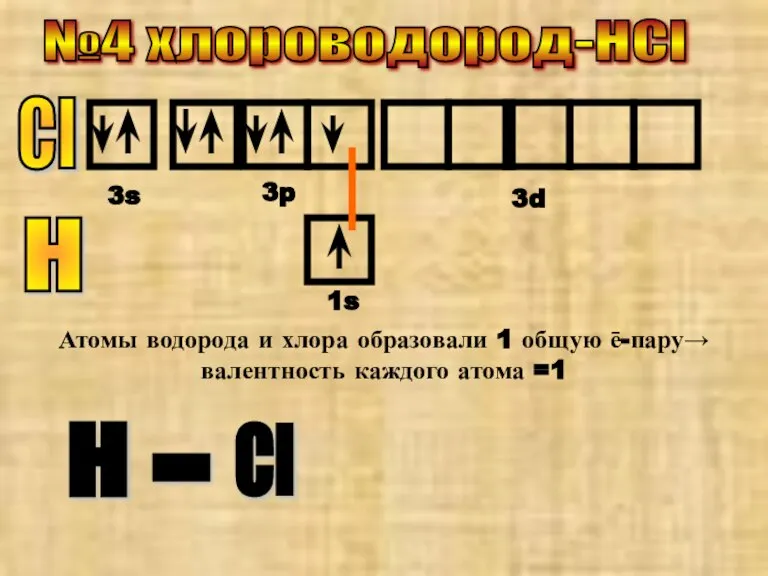
- 5. №4 хлороводород-НCl Cl 3s 3p 3d Н Атомы водорода и хлора образовали 1 общую ē-пару→ валентность
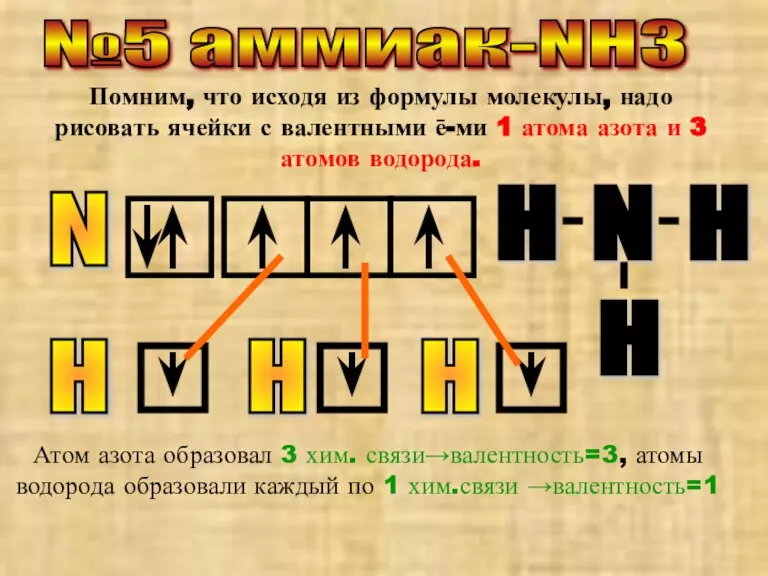
- 6. №5 аммиак-NH3 Помним, что исходя из формулы молекулы, надо рисовать ячейки с валентными ē-ми 1 атома
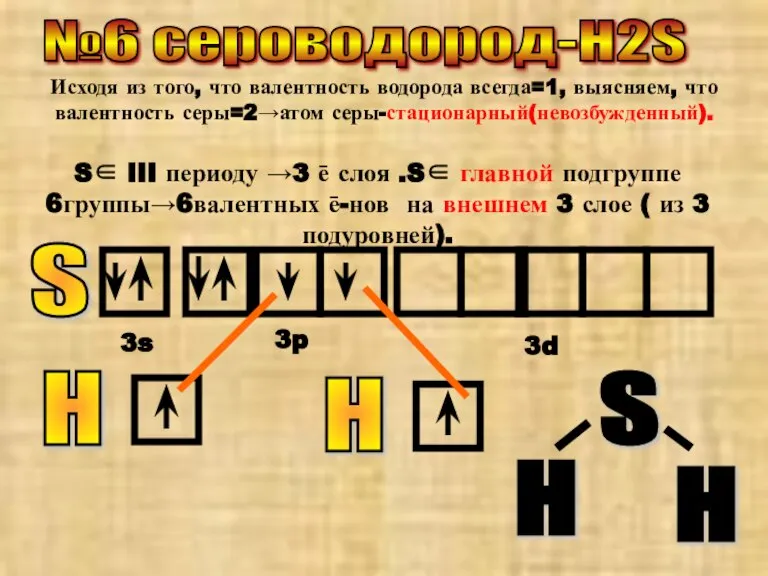
- 7. №6 сероводород-H2S Исходя из того, что валентность водорода всегда=1, выясняем, что валентность серы=2→атом серы-стационарный(невозбужденный). S∈ III
- 8. №7 фторид бериллия ВеF2 Из формулы соединения видно, что валентность Ве=2. Также Ве∈главной подгруппе 2 группы
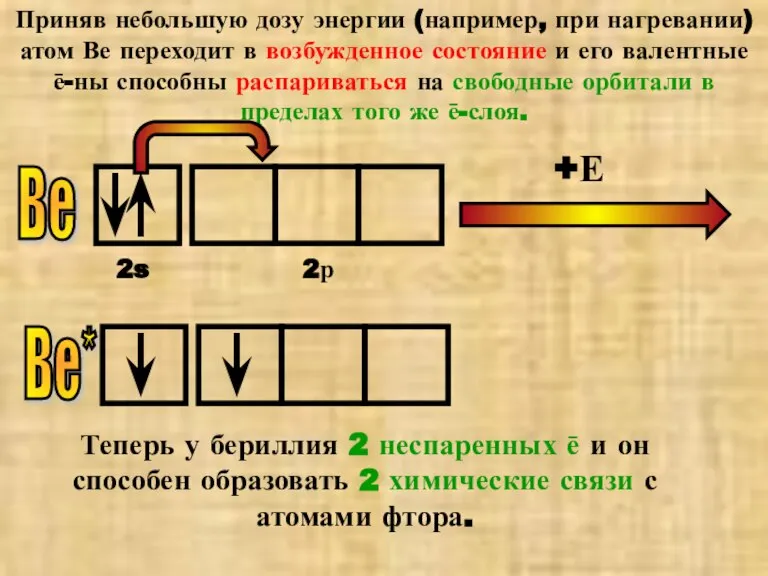
- 9. Приняв небольшую дозу энергии (например, при нагревании) атом Ве переходит в возбужденное состояние и его валентные
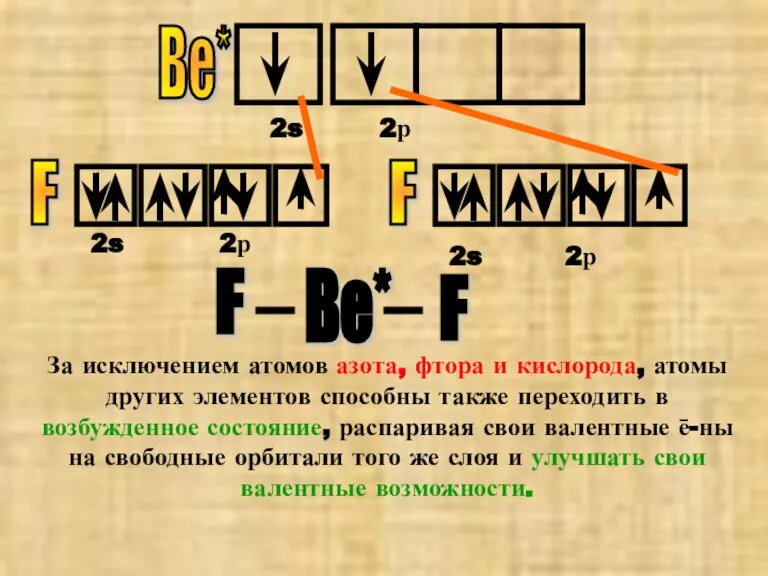
- 10. Ве* F F 2s 2s 2s Ве* F F 2р 2р 2р За исключением атомов азота,
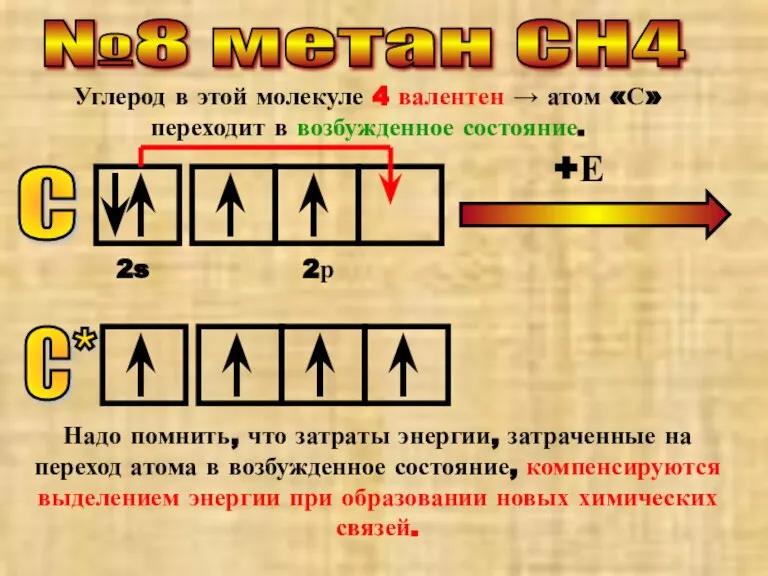
- 11. №8 метан СН4 Углерод в этой молекуле 4 валентен → атом «С» переходит в возбужденное состояние.
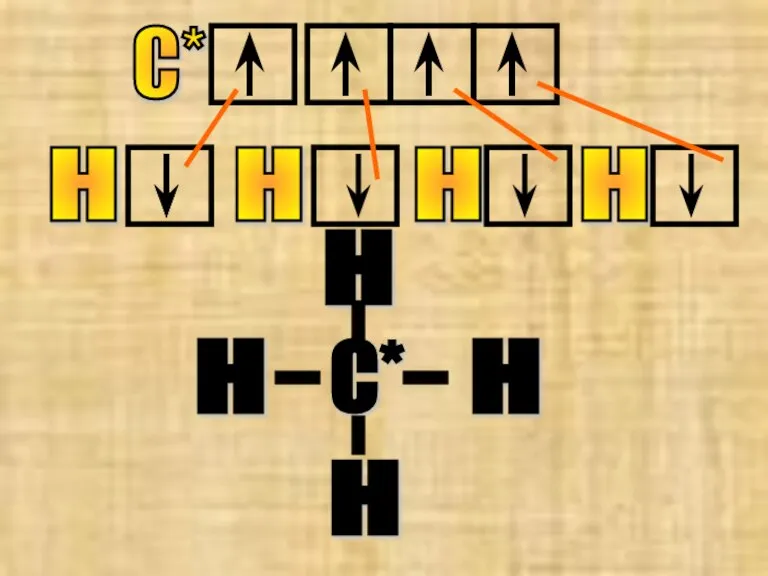
- 12. С* Н Н Н Н С* Н Н Н Н
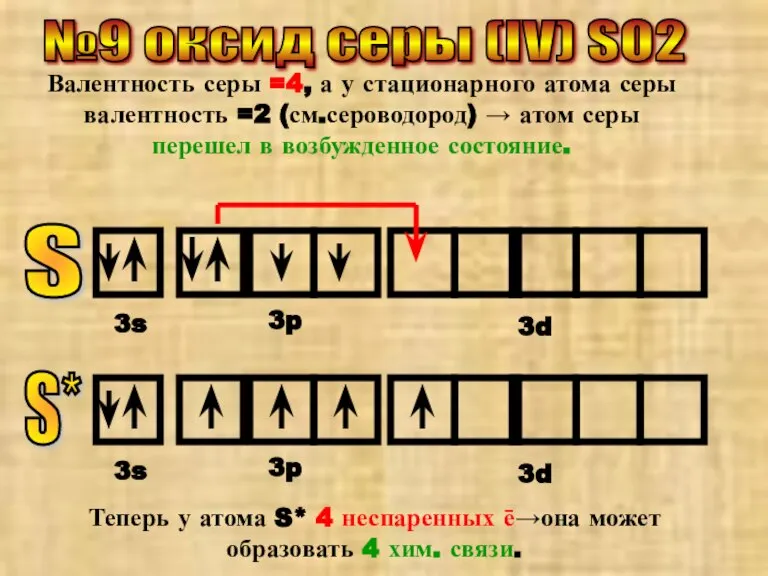
- 13. №9 оксид серы (IV) SO2 Валентность серы =4, а у стационарного атома серы валентность =2 (см.сероводород)
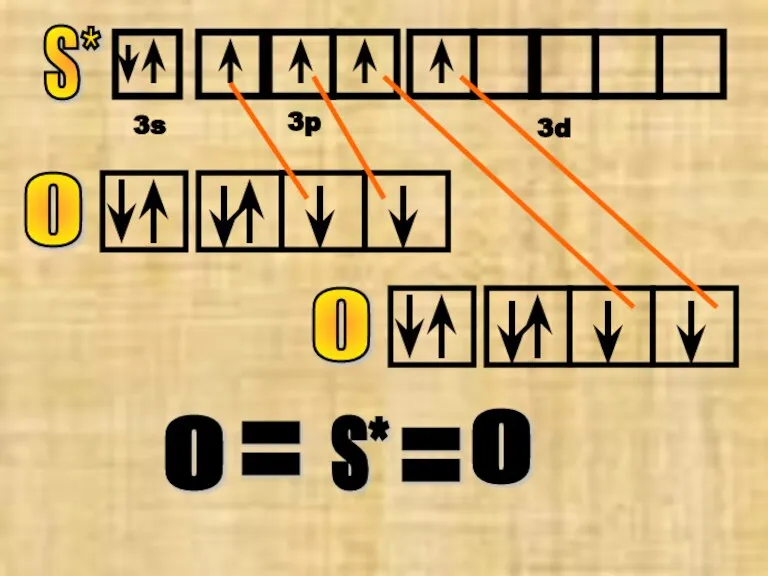
- 14. S* 3s 3p 3d О О S* О О = =
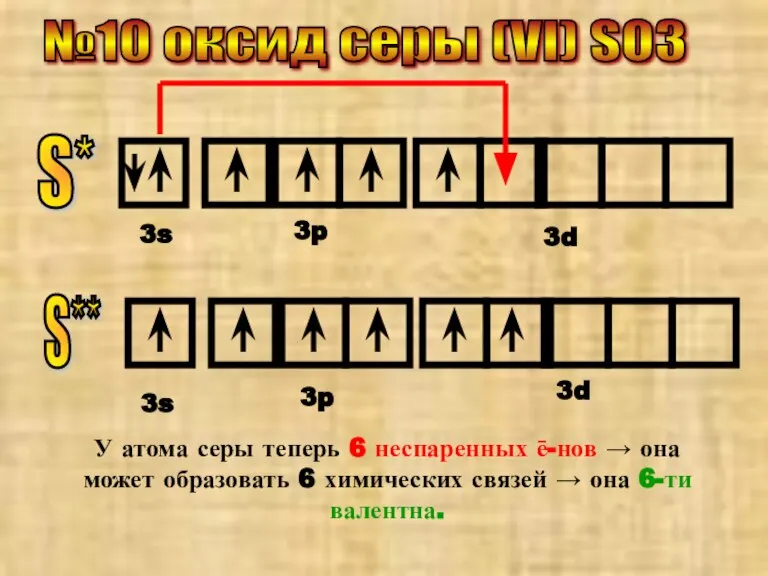
- 15. №10 оксид серы (VI) SO3 S* 3s 3p 3d S** 3s 3p 3d У атома серы
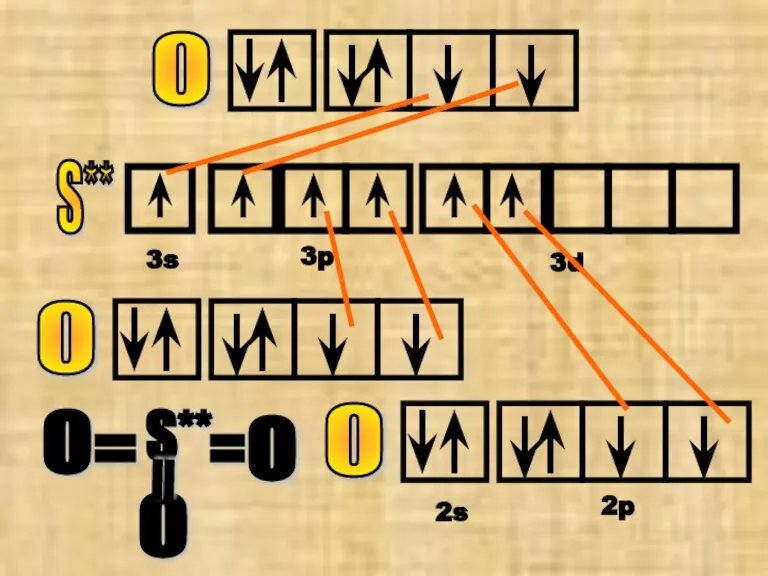
- 16. S** 3s 3p 3d О О О S** О О О = = = 2s 2p
- 17. 11 класс Из этой части презентации узнаем, как атомы дополнительно улучшают свои валентные возможности, а также
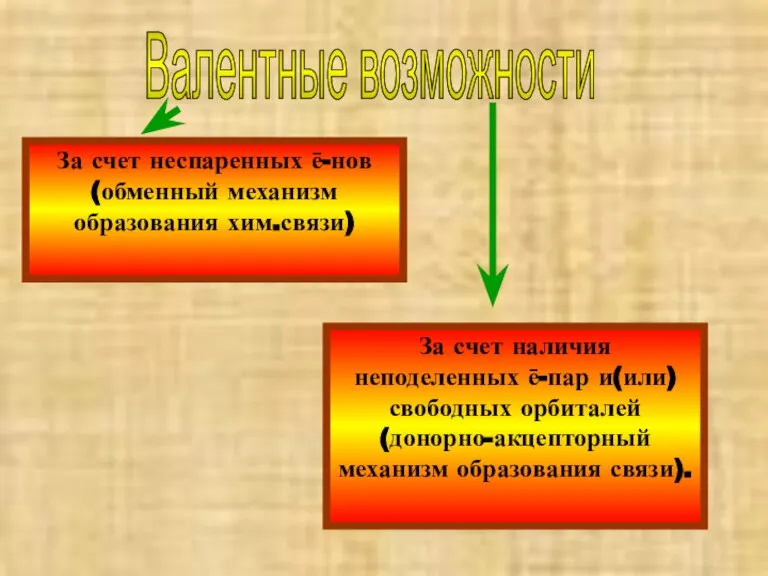
- 18. Валентные возможности За счет неспаренных ē-нов (обменный механизм образования хим.связи) За счет наличия неподеленных ē-пар и(или)
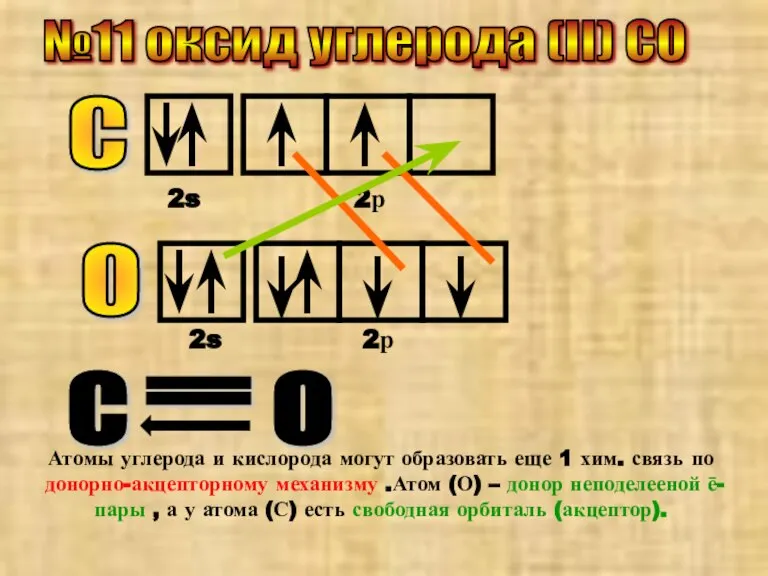
- 19. №11 оксид углерода (II) CO С 2s 2р О 2s 2р С О = Атомы углерода
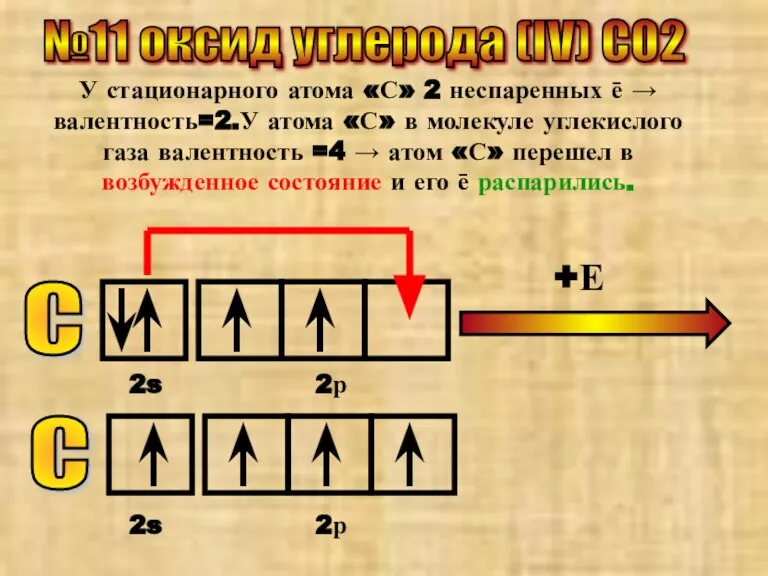
- 20. №11 оксид углерода (IV) CO2 У стационарного атома «С» 2 неспаренных ē → валентность=2.У атома «С»
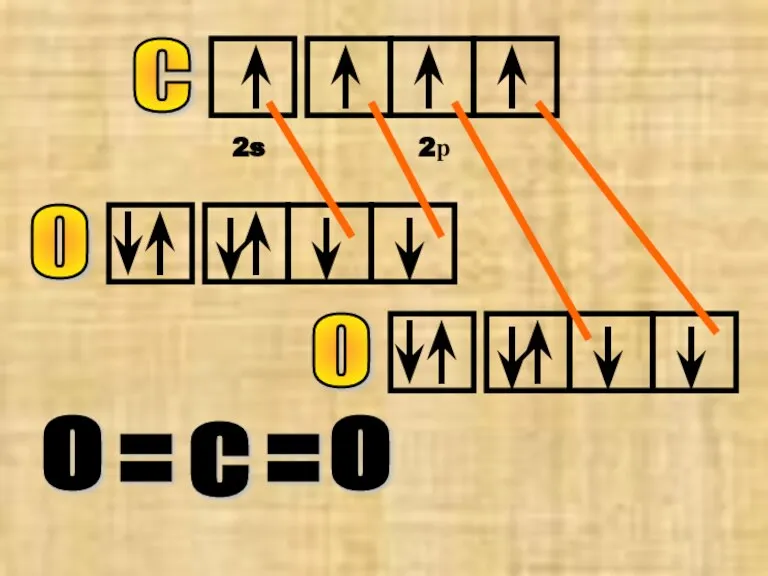
- 21. С 2s 2р О О С О О = =
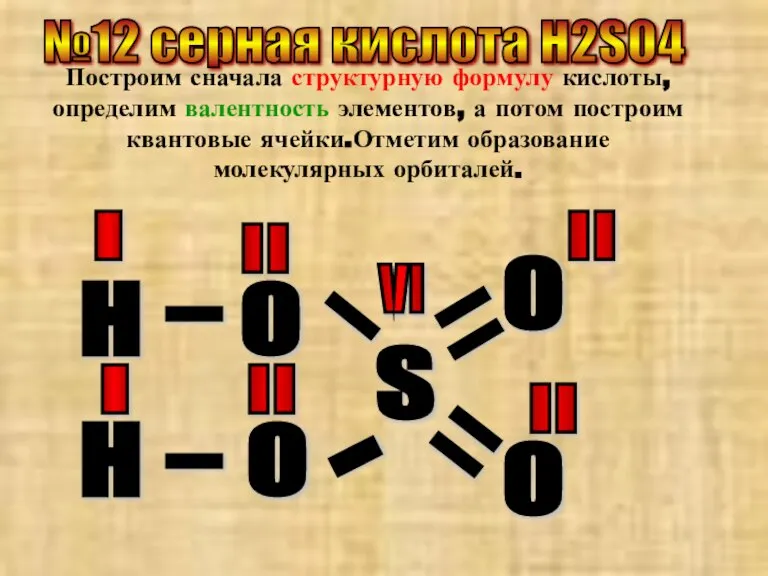
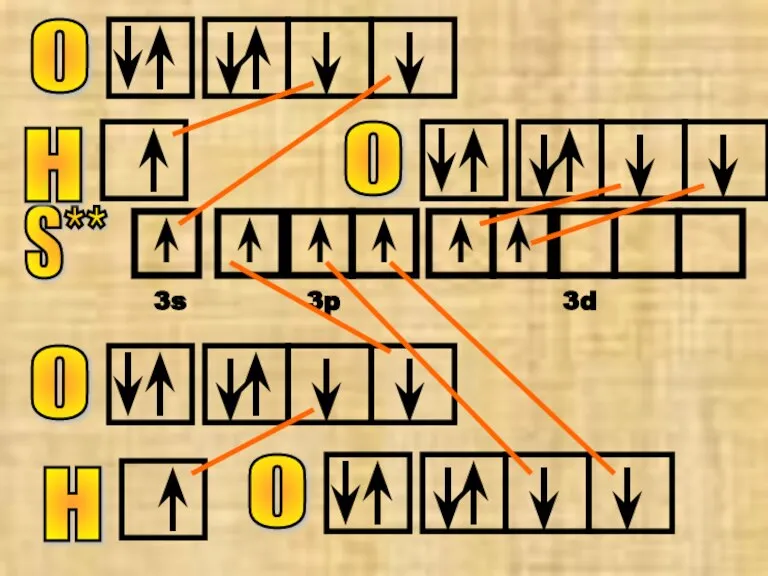
- 22. №12 серная кислота Н2SO4 Построим сначала структурную формулу кислоты, определим валентность элементов, а потом построим квантовые
- 23. S** 3s 3p 3d О О О О H H
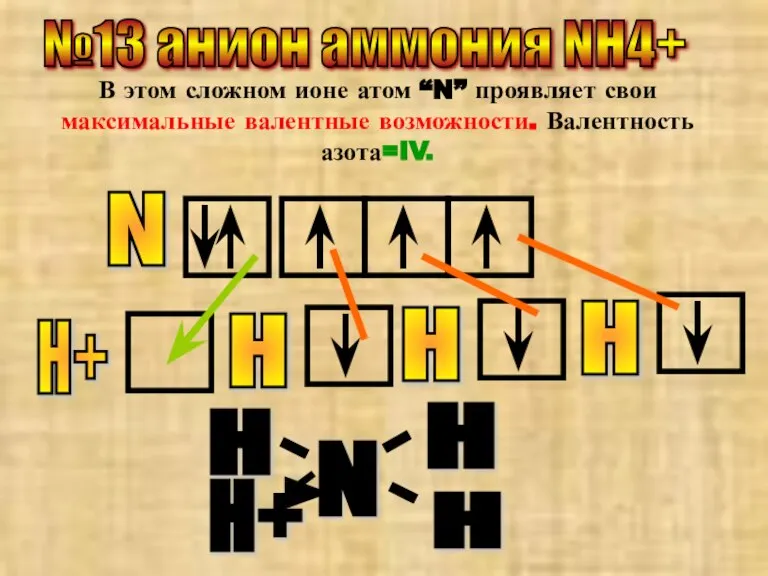
- 24. №13 анион аммония NH4+ В этом сложном ионе атом “N” проявляет свои максимальные валентные возможности. Валентность
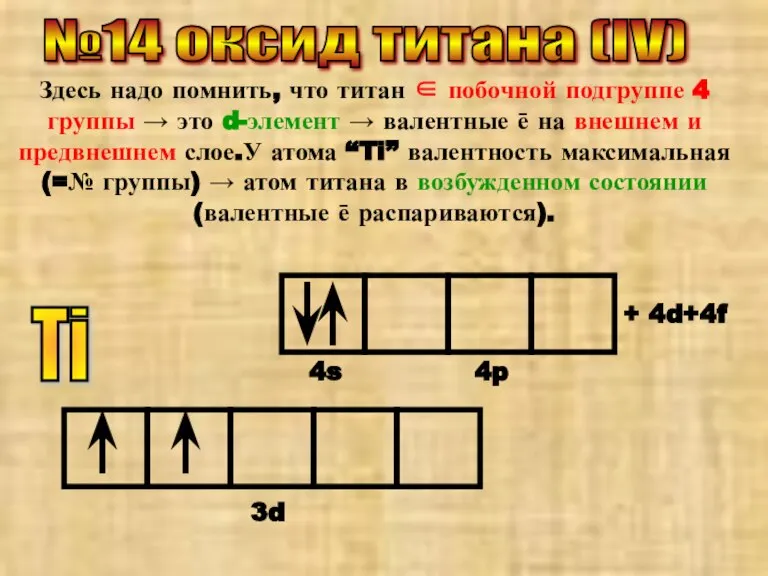
- 25. №14 оксид титана (IV) Здесь надо помнить, что титан ∈ побочной подгруппе 4 группы → это
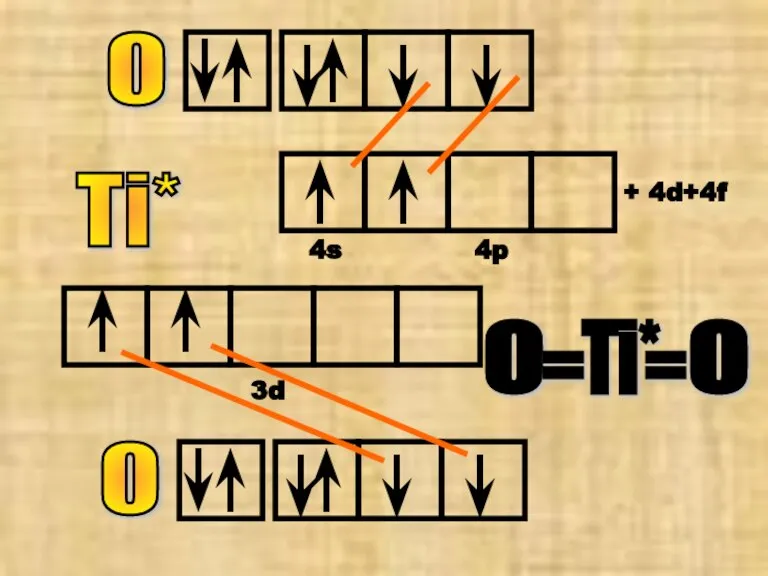
- 26. Ti* 3d 4s 4p + 4d+4f О О Ti* О О = =
- 27. Особый случай- O* и N* Атомы азота и кислорода не могут распарить свои валентные ē на
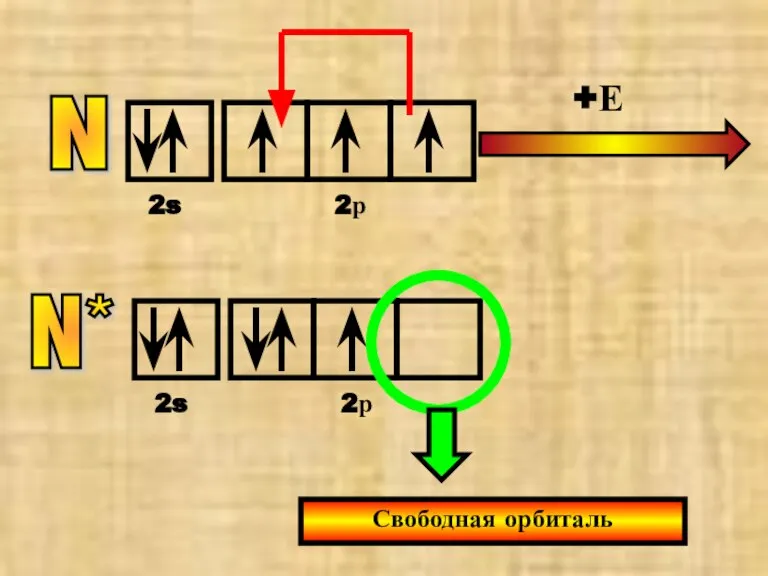
- 28. N 2s 2р +Е N* 2s 2р Свободная орбиталь
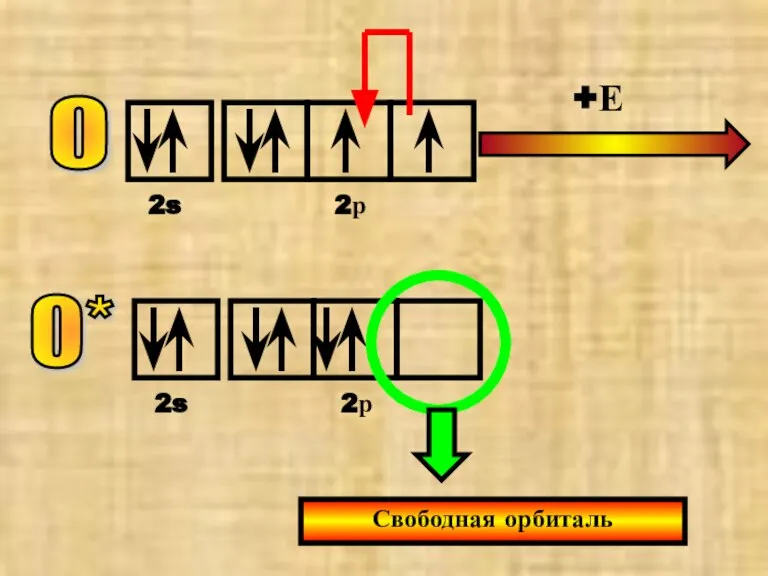
- 29. О 2s 2р +Е О* 2s 2р Свободная орбиталь
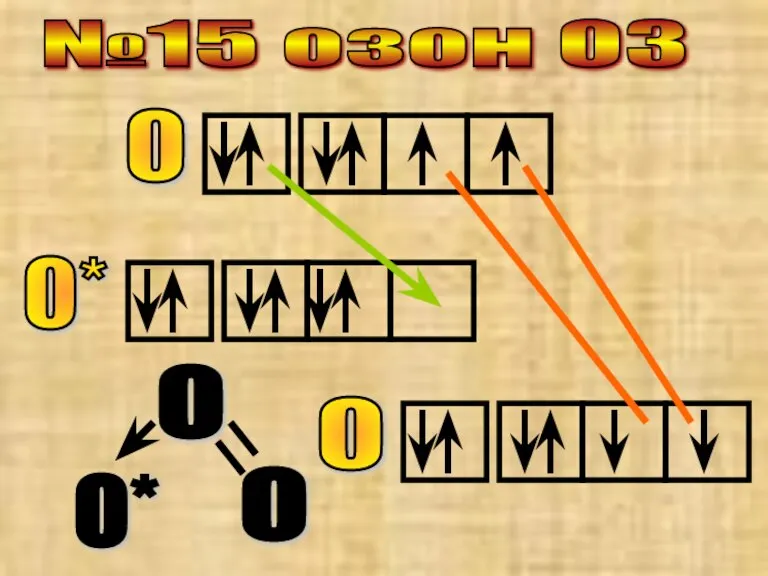
- 30. №15 озон О3 О О* О О О О*
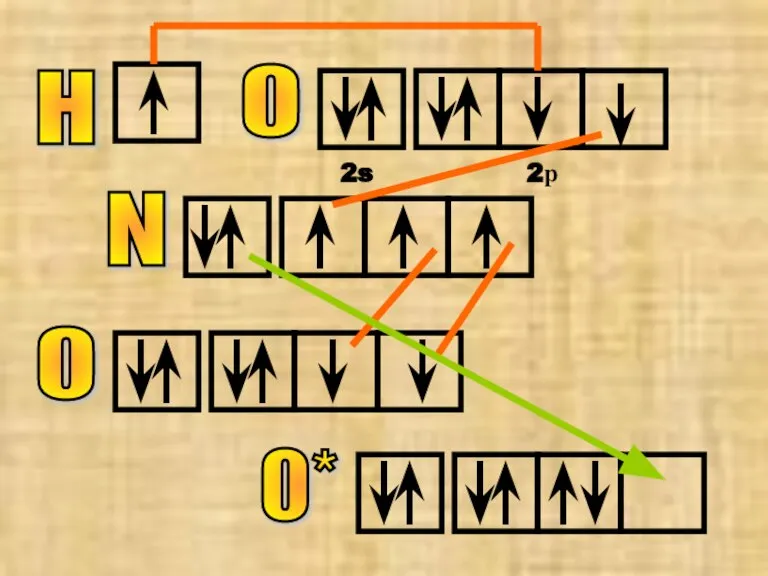
- 31. №16 азотная кислота НNO3 N H О О О* IV В этом соединении не надо путать
- 32. N H О 2s 2р О О*
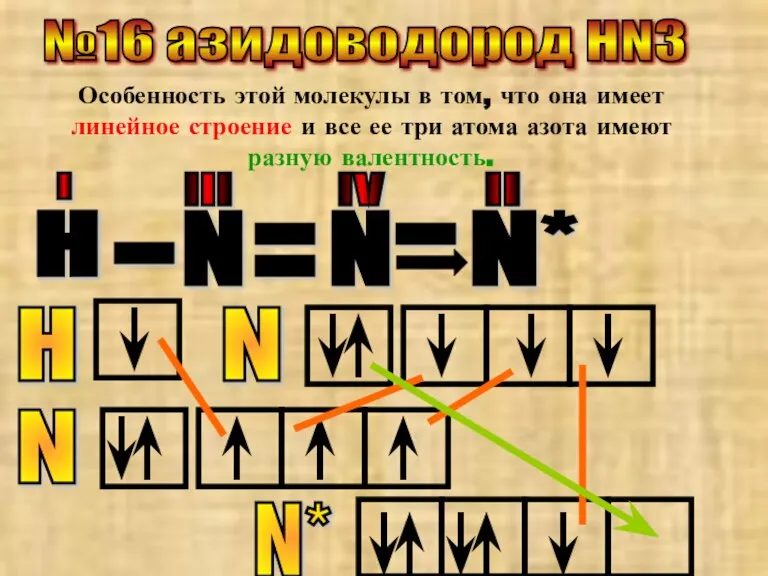
- 33. №16 азидоводород HN3 Особенность этой молекулы в том, что она имеет линейное строение и все ее
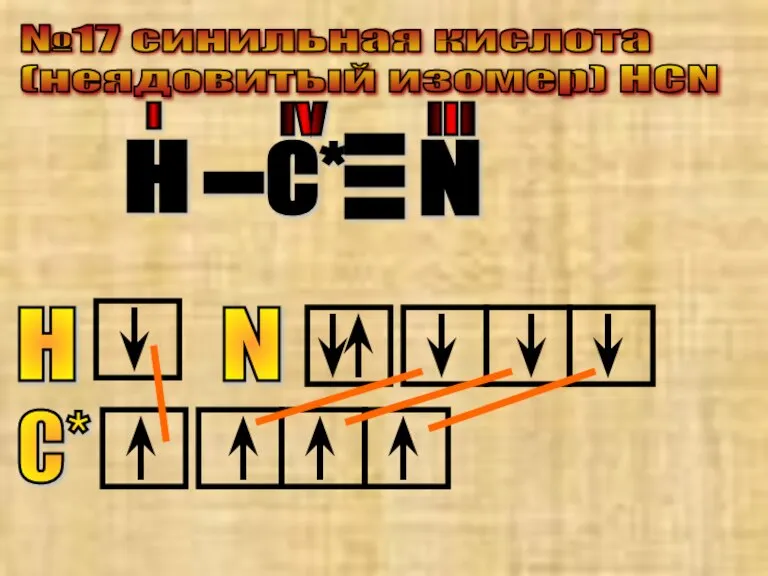
- 34. №17 cинильная кислота (неядовитый изомер) HCN С* N - - - H - IV III I
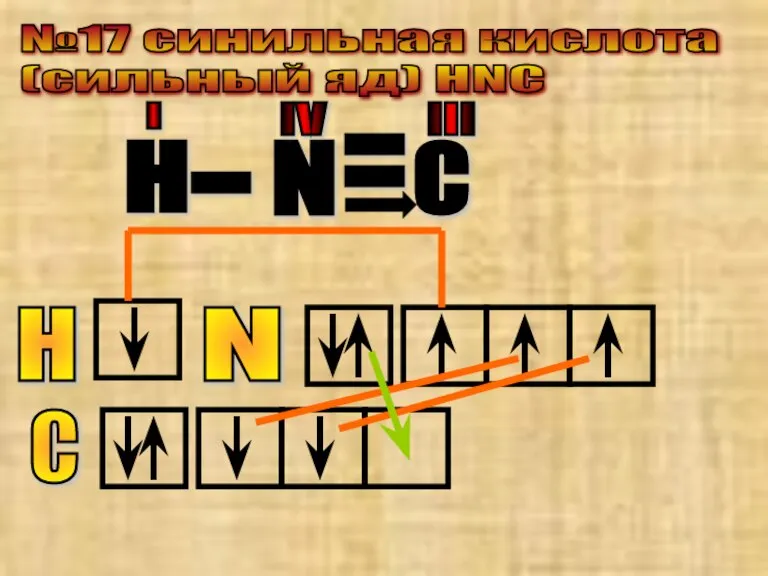
- 35. №17 cинильная кислота (сильный яд) HNC С N - H - - С H N IV
- 37. Скачать презентацию



 Химические равновесия в растворах. Лекция 2. Часть 1
Химические равновесия в растворах. Лекция 2. Часть 1 Как искупаться дома в морской воде?
Как искупаться дома в морской воде? Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу
Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу Протолитическая теория кислот и оснований. Буферные растворы
Протолитическая теория кислот и оснований. Буферные растворы Determination of optical properties of pentacoordinated silicon complexes using DFT method
Determination of optical properties of pentacoordinated silicon complexes using DFT method Малотоннажные термопласты
Малотоннажные термопласты Строение атома
Строение атома Презентация на тему Применение кислорода
Презентация на тему Применение кислорода  Химические знания - в жизнь. Основы нутрициологии
Химические знания - в жизнь. Основы нутрициологии Peek. Сферы применения
Peek. Сферы применения Типы химических реакций
Типы химических реакций Svins. Iegūšana
Svins. Iegūšana Применение серы, хлора, углерода
Применение серы, хлора, углерода Радиоакивные металлы
Радиоакивные металлы Понятие о сплавах и методах их получения
Понятие о сплавах и методах их получения Алкины
Алкины Кислоты, их состав и название
Кислоты, их состав и название Мезомерный эффект
Мезомерный эффект Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс  Сера
Сера Моделирование фазовых систем. Тройные взаимные системы
Моделирование фазовых систем. Тройные взаимные системы Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Презентация на тему Эфиры и жиры
Презентация на тему Эфиры и жиры  Металлы. Контрольная работа
Металлы. Контрольная работа Получение армированных фотополимерных композиций
Получение армированных фотополимерных композиций Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Презентация на тему Карбонаты
Презентация на тему Карбонаты 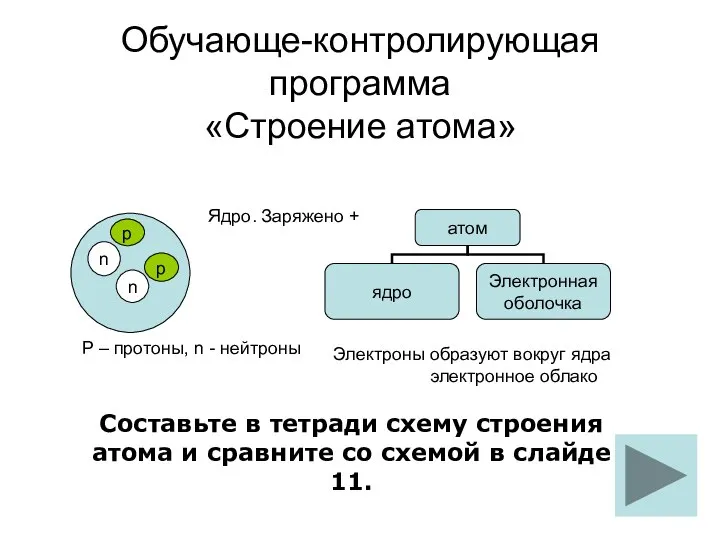 строение атома обуч-контр прогр
строение атома обуч-контр прогр