Содержание
- 2. В атмосфере незаметен, А в реакциях инертен. Может пользу приносить, В удобрениях служить… В организме пребывает,
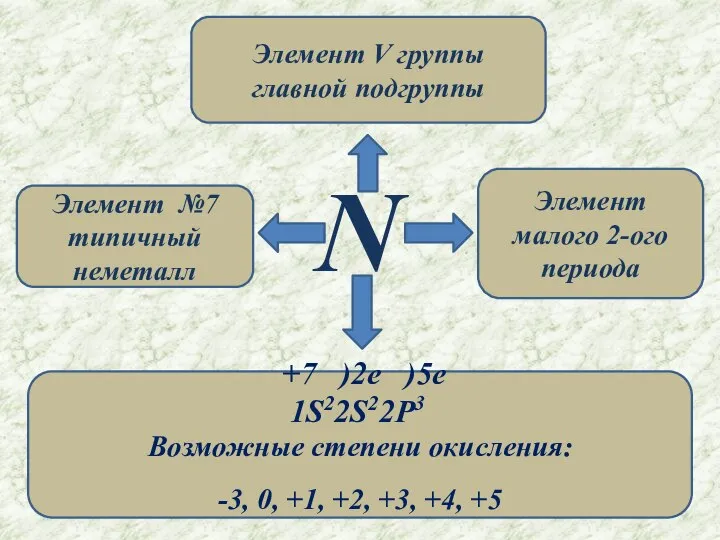
- 3. N Элемент №7 типичный неметалл Элемент V группы главной подгруппы Элемент малого 2-ого периода +7 )2e
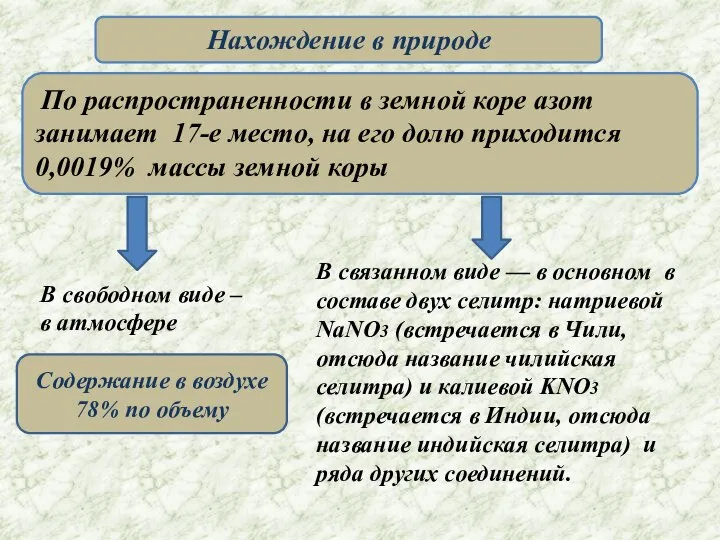
- 4. Нахождение в природе По распространенности в земной коре азот занимает 17-е место, на его долю приходится
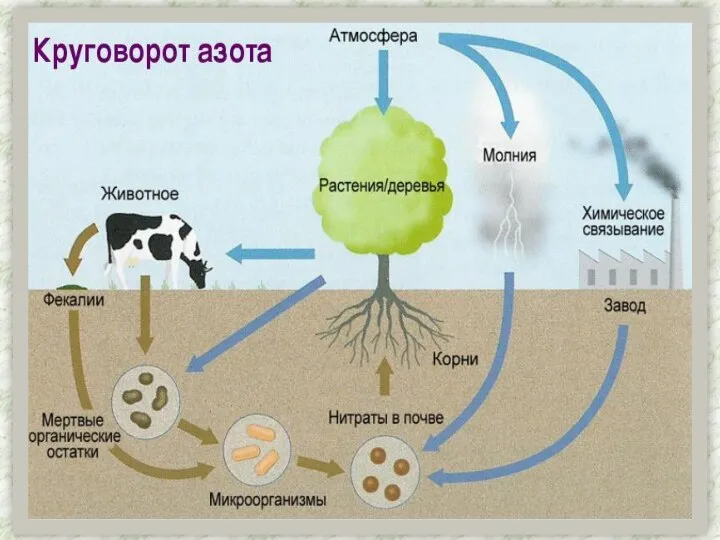
- 5. Азот присутствует во всех живых организмах (1-3% на сухую массу), являясь важнейшим биогенным элементом. Он входит
- 6. Молекула двухатомарная и очень прочная Структурная формула N N В нем молекулярная решетка и ковалентная неполярная
- 8. Азот — газ без цвета, запаха и вкуса. Мало растворим в воде (в 100 объемах воды
- 9. Азот реагирует с кислородом (при температуре электрической дуги) N2 + O2 =2NO 2. Азот реагирует с
- 10. Завод по производству азота из жидкого воздуха ОАО «Невинномысский Азот" Получение азота в промышленности: Фракционной перегонкой
- 11. Получение азота в лаборатории (разложением солей аммония) 1. Разложением нитрита аммония NH4NO2=N2 + 2H2O 2. Разложением
- 12. Применение Как хладагент В косметологии Для создания инертной среды при опытах Для синтеза аммиака N2
- 14. Скачать презентацию








 Оксиды азота
Оксиды азота Особенности базового курса органической химии издательства «ОЛМА»
Особенности базового курса органической химии издательства «ОЛМА» Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя
Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя  Карбоновые кислоты
Карбоновые кислоты Смачивание и не смачивание жидкости. Капилляры
Смачивание и не смачивание жидкости. Капилляры Углерод
Углерод Расстворение. Расстворы
Расстворение. Расстворы Аллотропия Аллотропные видоизменения (модификации)
Аллотропия Аллотропные видоизменения (модификации) Якісні реакції органічних речовин
Якісні реакції органічних речовин Окислительно-восстановительные свойства неорганических кислот
Окислительно-восстановительные свойства неорганических кислот Образование химических связей
Образование химических связей Коррозия металлов
Коррозия металлов Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде История развития химии
История развития химии Определение содержание фосфатов в воде фотометрическим методом
Определение содержание фосфатов в воде фотометрическим методом Висмут Bi
Висмут Bi Химические реактивы
Химические реактивы Презентация на тему Минеральные вещества
Презентация на тему Минеральные вещества  Водные растворы электролитов
Водные растворы электролитов Особо чистые вещества. Занятие 12
Особо чистые вещества. Занятие 12 Group 6 Cations
Group 6 Cations Spectroscopy. U.V. Lect.2
Spectroscopy. U.V. Lect.2 Эмульсия. Основные типы эмульсий
Эмульсия. Основные типы эмульсий Обобщение и систематизация знаний по теме Углеводороды
Обобщение и систематизация знаний по теме Углеводороды Степень окисления
Степень окисления Изотопная геохимия. Лекция 4-5
Изотопная геохимия. Лекция 4-5 Азот
Азот Лекция 4 Строение атома
Лекция 4 Строение атома