Содержание
- 2. Рекомендуемая литература Глинка Н.Л. Общая химия Коровин Н.В., Масленникова Г.Н. и др. Курс общей химии Глинка
- 3. Химия - это наука о веществах и законах их превращений. Объектом изучения в химии являются химические
- 5. Основные химические законы Закон сохранения массы веществ М.В. Ломоносов, 1748 г.; А. Лавуазье, 1789 г. Масса
- 6. Основные химические законы Закон постоянства состава Ж. Пруст, 1808 г. Все индивидуальные химические вещества имеют постоянный
- 7. Основные химические законы Закон Авогадро 1811 г. В равных объемах различных газов при одинаковых условиях (температура,
- 8. Химические реакции Взаимодействие химических соединений записывается с помощью химических уравнений, отражающих материальный баланс всех реагирующих веществ.
- 9. 1. Реакции соединения:
- 10. 2. Реакции замещения:
- 11. 3. Реакции разложения:
- 12. 4. Реакции обмена:
- 13. Реакции, сопровождающиеся изменением степени окисления всех или некоторых реагирующих веществ, называются окислительно-восстановительными. К таковым относятся:
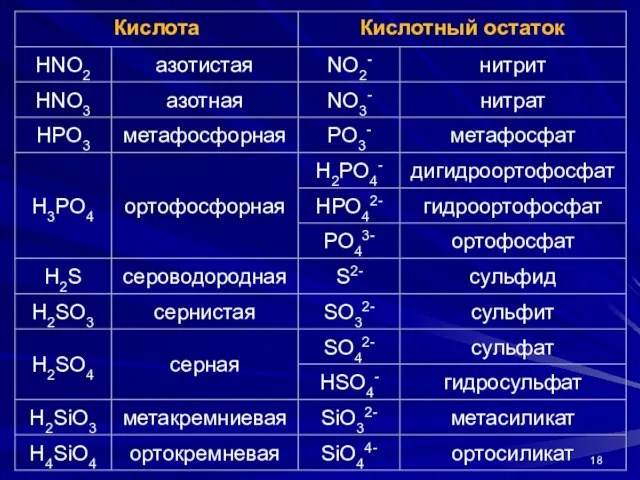
- 14. Одноатомные катионы называют по русскому названию элемента в родительном падеже и указанием степени окисления в скобках
- 15. Номенклатура неорганических соединений Анионы, состоящие из одного атома или нескольких одинаковых атомов, называют по элементу с
- 16. Номенклатура неорганических соединений Сложные гетероатомные анионы элементов в высшей степени окисления оканчивается на «-ат»: SO42- –
- 20. Скачать презентацию
















 Минералы
Минералы Органическая химия
Органическая химия Производство серной кислоты
Производство серной кислоты Презентация на тему Предмет химии Вещества
Презентация на тему Предмет химии Вещества  Презентация на тему Роль химии в жизни общества
Презентация на тему Роль химии в жизни общества  Электронное строение
Электронное строение Резина на основе нитрильных каучуков с повышенными эксплуатационными свойствами. Разработка
Резина на основе нитрильных каучуков с повышенными эксплуатационными свойствами. Разработка Спирты и фенолы
Спирты и фенолы Пространственное строение органических соединений
Пространственное строение органических соединений 7_ANIONY_1_angr
7_ANIONY_1_angr Простагландины. Воздействие фосфолипаз на фосфолипид
Простагландины. Воздействие фосфолипаз на фосфолипид Аналитическая химия. Введение
Аналитическая химия. Введение Термодинамика и теплопередача. Реальные газы
Термодинамика и теплопередача. Реальные газы Свойства неметаллов и их соединений
Свойства неметаллов и их соединений Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II
Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II Углеводороды в природе
Углеводороды в природе Химическое равновесие
Химическое равновесие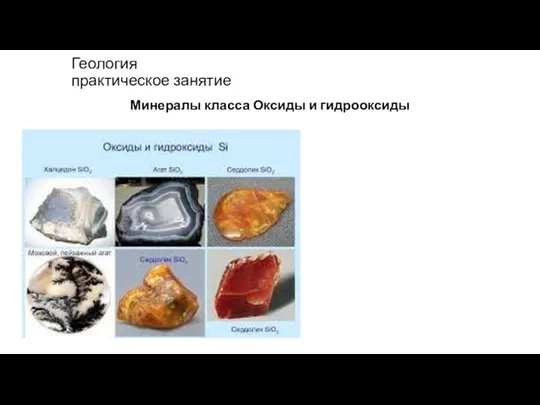 Оксиды и гидрооксиды
Оксиды и гидрооксиды Презентация на тему Всё о кремнии
Презентация на тему Всё о кремнии  Казанская химическая школа
Казанская химическая школа Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи
Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2) Чистые вещества и смеси
Чистые вещества и смеси Сследование коэффициентов переноса жидкостей в молекулярных моделях opls и saft
Сследование коэффициентов переноса жидкостей в молекулярных моделях opls и saft Сероводород, сульфиды
Сероводород, сульфиды Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Металлы. Группы металлов
Металлы. Группы металлов