Содержание
Слайд 2Вещества
Простые
образованы
атомами одного химического элемента
Сложные
образованы
атомами нескольких химических элементов
Металлы (Ме)
Неметаллы (неМе)
Неорганические
(минеральные)
Органические
(соединения углерода
Вещества
Простые
образованы
атомами одного химического элемента
Сложные
образованы
атомами нескольких химических элементов
Металлы (Ме)
Неметаллы (неМе)
Неорганические
(минеральные)
Органические
(соединения углерода
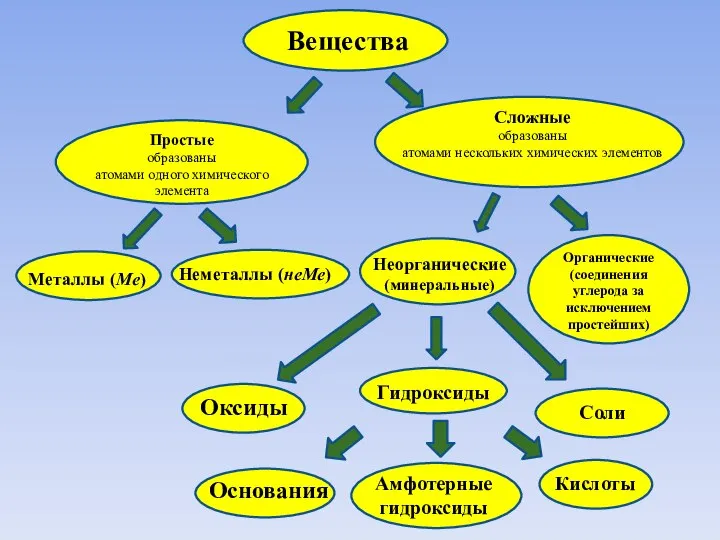
Оксиды
Гидроксиды
Кислоты
Соли
Амфотерные
гидроксиды
Основания
Слайд 4Оксиды
Солеобразующие
В результате химических реакций образуют соли
CuO + 2HCl → CuCl2 + H2O
CO2 +
Оксиды
Солеобразующие
В результате химических реакций образуют соли
CuO + 2HCl → CuCl2 + H2O
CO2 +
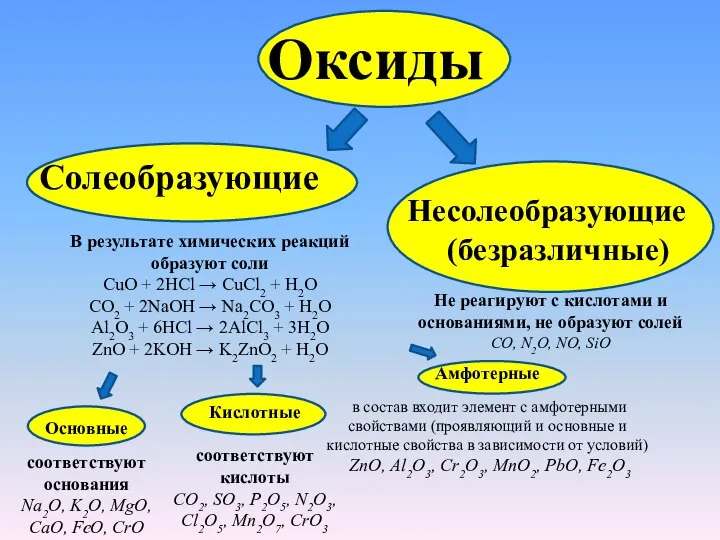
Al2O3 + 6HCl → 2AlCl3 + 3H2O
ZnO + 2KOH → K2ZnO2 + H2O
Несолеобразующие
(безразличные)
Не реагируют с кислотами и основаниями, не образуют солей
СО, N2O, NO, SiO
Основные
соответствуют основания
Na2O, K2O, MgO, CaO, FeO, CrO
Кислотные
соответствуют кислоты
CO2, SO3, P2O5, N2O3, Cl2O5, Mn2O7, CrO3
Амфотерные
в состав входит элемент с амфотерными свойствами (проявляющий и основные и кислотные свойства в зависимости от условий)
ZnO, Al2O3, Cr2O3, MnO2, PbO, Fe2O3





 Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Составление формул по валентности
Составление формул по валентности Ртуть. Правила работы со ртутью
Ртуть. Правила работы со ртутью Нефть и основные продукты её переработки
Нефть и основные продукты её переработки lll-l группы главные подгруппы. 11 класс
lll-l группы главные подгруппы. 11 класс Ионообменная хроматография в разделении белков
Ионообменная хроматография в разделении белков Магний и его сплавы
Магний и его сплавы Получение и применение алканов (10 класс)
Получение и применение алканов (10 класс) Электролиз воды
Электролиз воды Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C
Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C Фторопласты и их использование
Фторопласты и их использование Теория электролитической диссоциации
Теория электролитической диссоциации Нанокристаллические и аморфные металлы и сплавы
Нанокристаллические и аморфные металлы и сплавы Скорость химических реакций
Скорость химических реакций Презентация на тему М.В. Ломоносов
Презентация на тему М.В. Ломоносов  Фосфор. Элемент жизни и мысли
Фосфор. Элемент жизни и мысли Хлордың қолданылуы
Хлордың қолданылуы Теория растворов. (Тема 1.5)
Теория растворов. (Тема 1.5) Презентация на тему Волокна
Презентация на тему Волокна  Химические элементы, входящие в состав питательных веществ
Химические элементы, входящие в состав питательных веществ Вода – самое удивительное вещество на Земле
Вода – самое удивительное вещество на Земле Презентация на тему Вредное воздействие нитратов на организм человека
Презентация на тему Вредное воздействие нитратов на организм человека  Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  10.1С_Серная кислота
10.1С_Серная кислота Полимеры. Функции полимеров
Полимеры. Функции полимеров Роль нитрадов. Взгляд специалистов
Роль нитрадов. Взгляд специалистов ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы
ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы Презентация на тему Химия моя профессия
Презентация на тему Химия моя профессия