Содержание
- 2. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Полиморфизм Полиморфизм – способность твердых веществ и жидких кристаллов существовать в двух или нескольких формах
- 3. ТюмГНГУ,МиТКМ,ЗолотареваЕВ 1.1. Полиморфное превращение В металлических кристаллах плотноупакованные структуры вследствие меньшей энтропии устойчивы при низких температурах.
- 4. ТюмГНГУ,МиТКМ,ЗолотареваЕВ 1.2. Полиморфные переходы 1-го и 2-го рода. Полиморфные переходы могут быть фазовыми переходами как 1-го,
- 5. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Железо Железо – один из самых распространенных элементов в природе, его содержание в земной коре
- 6. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Кривая охлаждения чистого железа
- 7. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Углерод является неметаллическим элементом II периода четвертой группы, атомный номер 6, плотность 2,5 г/см3, атомная
- 8. ТюмГНГУ,МиТКМ,ЗолотареваЕВ ФАЗЫ В СИСТЕМЕ ЖЕЛЕЗО-УГЛЕРОД В системе Fe - С различают следующие фазы: жидкий сплав, твердые
- 9. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Цементит. Это химическое соединение железа с углеродом — карбид железа Fe3C . В цементите содержится
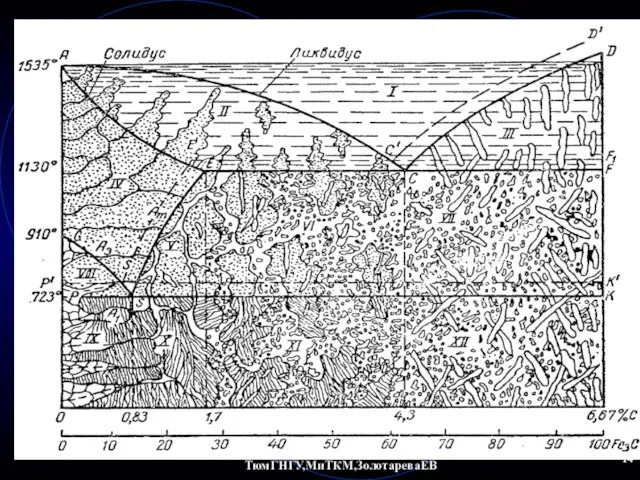
- 10. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Диаграмма состояния Fe-Fe3C На диаграмме Fe-Fe3C выделяются следующие характерные температуры: A0 – 210 °C: Fe3C
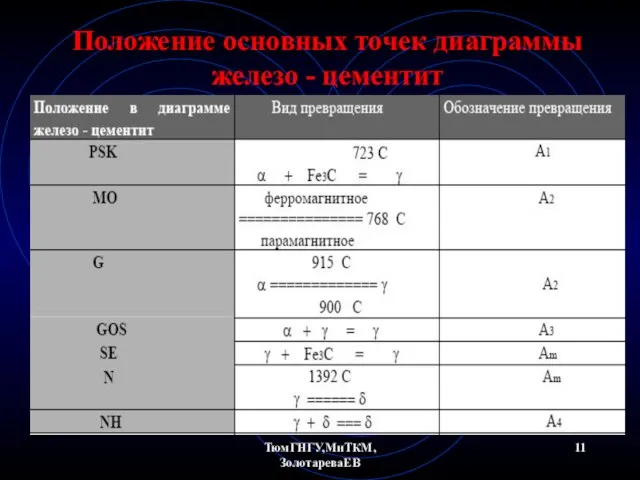
- 11. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Положение основных точек диаграммы железо - цементит
- 12. ТюмГНГУ,МиТКМ,ЗолотареваЕВ
- 13. ТюмГНГУ,МиТКМ,ЗолотареваЕВ
- 14. ТюмГНГУ,МиТКМ,ЗолотареваЕВ
- 15. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Стали и чугуны Основными сплавами железа являются его сплавы с углеродом – стали и чугуны.
- 16. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Стали По структурным свойствам стали подразделяют на доэвтектоидные и заэвтектоидные относительно эвтектоидного состава 0,8 %
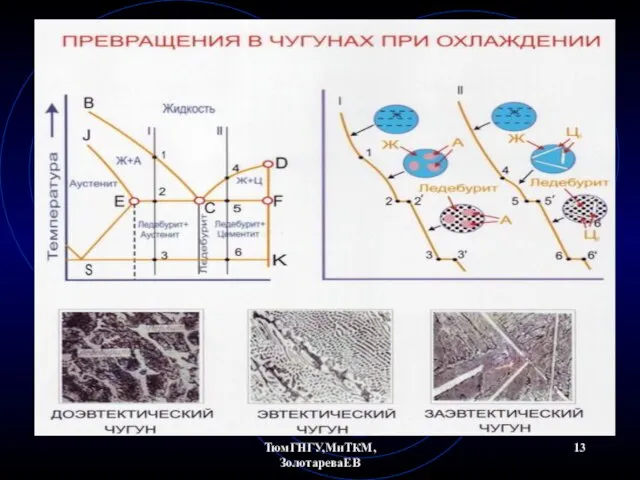
- 17. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Чугуны Чугуны по структурным свойствам подразделяют на доэвтектические и заэвтектические относительно эвтектического состава 4,3 %
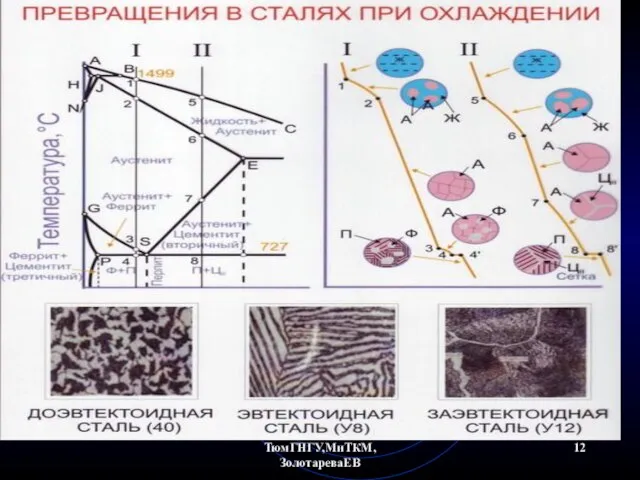
- 18. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Диаграмма состояния Fe-Fe3C (а) и кривые охлаждения стали (б) и чугуна (в)
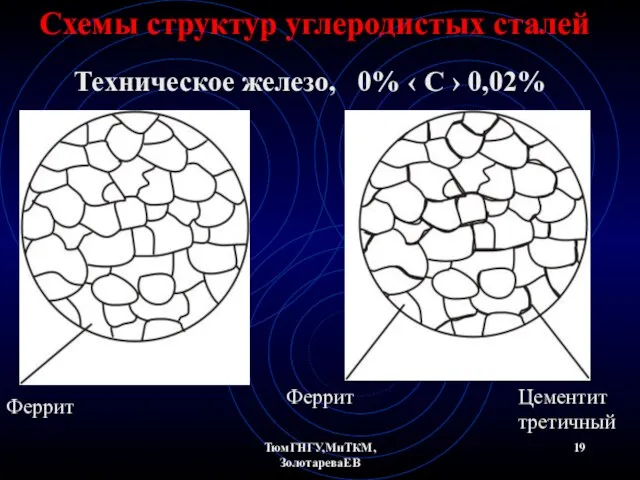
- 19. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Схемы структур углеродистых сталей Техническое железо, 0% ‹ С › 0,02% Феррит Феррит Цементит третичный
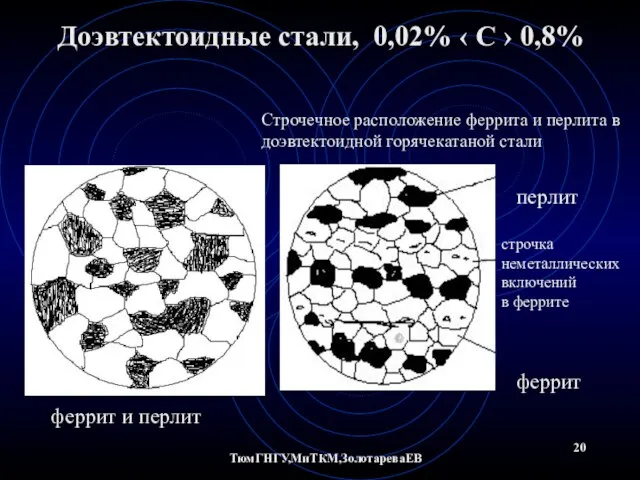
- 20. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Доэвтектоидные стали, 0,02% ‹ С › 0,8% феррит и перлит Строчечное расположение феррита и перлита
- 21. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Перлит в эвтектоидной стали, С = 0,8% Строение пластинчатое. Пластинки цементита чередуются с пластинками феррита
- 22. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Структура заэвтектоидной стали, 0,8% ‹ С › 2,14% Перлит пластинчатый с цементитной "сеткой"
- 23. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Схемы структур белых чугунов Заэвтектический белый чугун. Цементит первичный и ледебурит, 4,3% ‹ С ›
- 24. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Схемы микроструктур чугуна в зависимости от металлической основы и формы графитовых включений
- 25. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Легирование Легирование – специальное введение в состав сплавов дополнительных химических элементов, называемых легирующими, с целью
- 26. ТюмГНГУ,МиТКМ,ЗолотареваЕВ Все примеси (химические элементы), содержащиеся в стали, можно разделить на четыре группы: 1. Постоянные примеси.
- 27. ТюмГНГУ,МиТКМ,ЗолотареваЕВ В промышленных легированных сталях, которые являются многокомпонентными системами, легирующие элементы находятся: а) в свободном состоянии;
- 29. Скачать презентацию




















 Кислоты: состав, классификация, номенклатура, получение
Кислоты: состав, классификация, номенклатура, получение Химический состав клетки
Химический состав клетки Типы химических реакций
Типы химических реакций Презентация на тему ИКТ на уроках химии
Презентация на тему ИКТ на уроках химии  Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Синтез.Малахит
Синтез.Малахит Дисперсные системы
Дисперсные системы Искусство фотографии и химия
Искусство фотографии и химия Zirconium Dioxide
Zirconium Dioxide Презентация на тему Белки
Презентация на тему Белки  Классификация химических реакций
Классификация химических реакций Кислоты в химии
Кислоты в химии Неметаллы. 8 класс
Неметаллы. 8 класс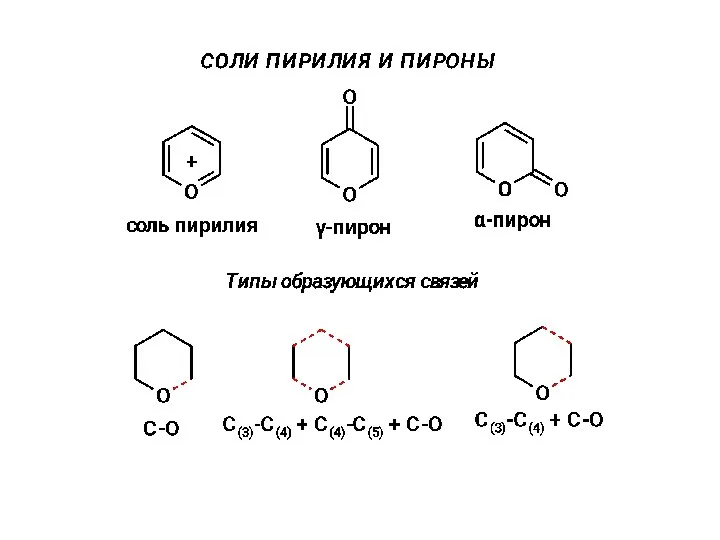 Соли пирилия и пироны
Соли пирилия и пироны Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения
Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6
Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6 Основы МКТ
Основы МКТ Презентация на тему Соли аммония
Презентация на тему Соли аммония  Силикаты
Силикаты Менделеевский период
Менделеевский период Мило. Його склад. Мийна дія
Мило. Його склад. Мийна дія Классификация оксидов по химическим свойствам
Классификация оксидов по химическим свойствам Химический элемент титан
Химический элемент титан Хімія у вирішенні промислової проблеми
Хімія у вирішенні промислової проблеми Молекулярно-кинетическая теория. Макро- и микропараметры
Молекулярно-кинетическая теория. Макро- и микропараметры Осмотическое давление
Осмотическое давление Гідроліз солей
Гідроліз солей Массовые доли растворенного вещества
Массовые доли растворенного вещества