Слайд 2ПОНЯТТЯ ПРО СТУПІНЬ ОКИСНЕННЯ

Слайд 3СТУПІНЬ ОКИСНЕННЯ І ВАЛЕНТНІСТЬ
СТУПІНЬ ОКИСНЕННЯ — ПОНЯТТЯ, ЩО ХАРАКТЕРИЗУЄ СТАН ЕЛЕМЕНТА

В ХІМІЧНІЙ СПОЛУЦІ ТА ЙОГО ПОВЕДІНКУ В ОКИСНО-ВІДНОВНИХ ПРОЦЕСАХ.
ЦЕ УМОВНИЙ ЗАРЯД, ВЕЛИЧИНА ЯКОГО РОЗРАХОВУЄТЬСЯ ВИХОДЯЧИ З ПРИПУЩЕННЯ, ЩО ВСІ ЕЛЕКТРОНИ, ЯКІ УТВОРЮЮТЬ ХІМІЧНИЙ ЗВ’ЯЗОК, ПОВНІСТЮ ПЕРЕХОДЯТЬ ДО БІЛЬШ ЕЛЕКТРОНЕГАТИВНОГО ЕЛЕМЕНТА.
ВАЛЕНТНІСТЬ — ХАРАКТЕРИСТИКА ЗДАТНОСТІ АТОМА УТВОРЮВАТИ ХІМІЧНІ ЗВ’ЯЗКИ.
ВИЗНАЧАЄТЬСЯ ЧИСЛОМ ЗВ’ЯЗКІВ, ЯКІ УТВОРЮЮТЬ ДАНИЙ АТОМ З ІНШИМИ АТОМАМИ В МОЛЕКУЛІ.
Слайд 5СТУПІНЬ ОКИСНЕННЯ І ВАЛЕНТНІСТЬ
(НА ПРИКЛАДІ N2)
ЕЛЕКТРОННА ФОРМУЛА АТОМА НІТРОГЕНУ:
НА ЗОВНІШНЬОМУ ЕНЕРГЕТИЧНОМУ РІВНІ

5 ЕЛЕКТРОНІВ,
ТРИ ІЗ ЯКИХ НЕСПАРЕНІ.
У МОЛЕКУЛІ АЗОТУ N2 НІТРОГЕН УТВОРЮЄ ТРИ КОВАЛЕНТНІ ЗВ’ЯЗКИ
ЙОГО ВАЛЕНТНІСТЬ ДОРІВНЮЄ ТРЬОМ.
ЗМІЩЕННЯ СПІЛЬНИХ ЕЛЕКТРОННИХ ПАР НЕ ВІДБУВАЄТЬСЯ, ВОНИ РІВНОВІДДАЛЕНІ ВІД ЯДЕР ОБОХ АТОМІВ
ТОМУ СТУПІНЬ ОКИСНЕННЯ НІТРОГЕНУ НУЛЬОВИЙ, А ТОДІ ЯК ОБИДВА АТОМИ – ТРИВАЛЕНТНІ.
Слайд 6ЗНАЧЕННЯ ВАЛЕНТНОСТІ Й СТУПЕНІВ ОКИСНЕННЯ ХІМІЧНИХ ЕЛЕМЕНТІВ У ДЕЯКИХ РЕЧОВИНАХ

Слайд 7ПРАВИЛА ВИЗНАЧЕННЯ СТУПЕНЯ ОКИСНЕННЯ

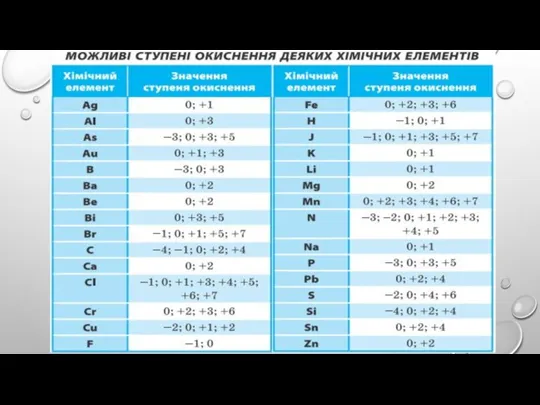
Слайд 9МОЖЛИВІ СТУПЕНІ ОКИСНЕННЯ ЕЛЕМЕНТІВ

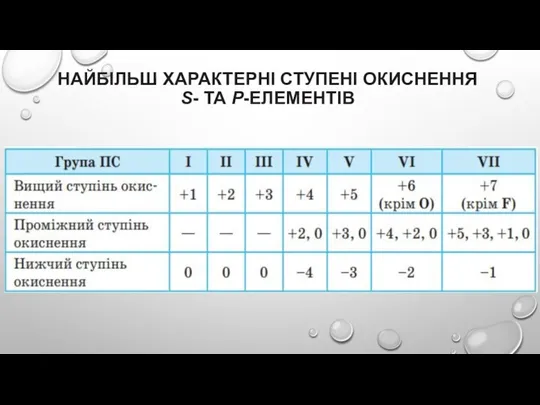
Слайд 10НАЙБІЛЬШ ХАРАКТЕРНІ СТУПЕНІ ОКИСНЕННЯ
S- ТА P-ЕЛЕМЕНТІВ
Слайд 12ДЕЯКІ ХІМІЧНІ ЕЛЕМЕНТИ НЕ ПІДПАДАЮТЬ ПІД ЦІ ПРАВИЛА.
СЕРЕД НИХ ГІДРОГЕН, ОКСИГЕН,
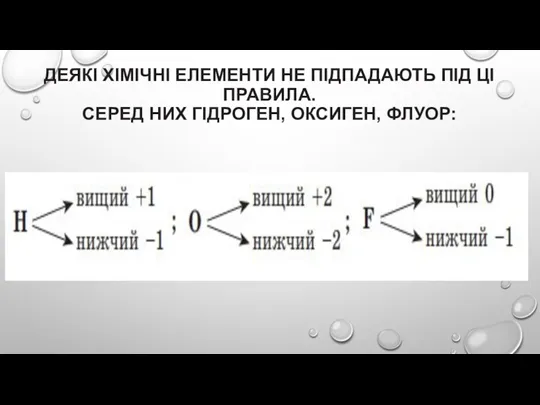
ФЛУОР:
Слайд 13ВИЗНАЧЕННЯ СТУПЕНІВ ОКИСНЕННЯ В БІНАРНИХ СПОЛУКАХ
ДЛЯ ВИЗНАЧЕННЯ СТУПЕНІВ ОКИСНЕННЯ У СПОЛУКАХ

НЕДОСТАТНЬО ЗНАТИ МОЖЛИВІ СТУПЕНІ ОКИСНЕННЯ ЕЛЕМЕНТІВ.
ДЛЯ ЦЬОГО СЛІД КОРИСТУВАТИСЯ ПЕВНИМИ ПРАВИЛАМИ. НАСАМПЕРЕД, ПРИНЦИПОМ ЕЛЕКТРОНЕЙТРАЛЬНОСТІ:
ОСКІЛЬКИ БУДЬ-ЯКА РЕЧОВИНА Є ЕЛЕКТРОНЕЙТРАЛЬНОЮ, ТО СУМА СТУПЕНІВ
ОКИСНЕННЯ АТОМІВ УСІХ ЕЛЕМЕНТІВ, З ЯКИХ СКЛАДАЄТЬСЯ РЕЧОВИНА, МАЄ ДОРІВНЮВАТИ НУЛЮ.
НАПРИКЛАД, ВИЗНАЧИМО СТУПЕНІ ОКИСНЕННЯ ЕЛЕМЕНТІВ У СУЛЬФУР(IV) ОКСИДІ SO2. В ОКСИДАХ СТУПІНЬ ОКИСНЕННЯ ОКСИГЕНУ ЗАВЖДИ ДОРІВНЮЄ –2. ОТЖЕ, ДЛЯ ТОГО ЩОБ НЕЙТРАЛІЗУВАТИ ЗАРЯД НА ДВОХ АТОМАХ ОКСИГЕНУ, В СУЛЬФУРУ СТУПІНЬ ОКИСНЕННЯ МАЄ БУТИ +4:
Слайд 14АЛГОРИТМ ВИЗНАЧЕННЯ СТУПЕНЯ ОКИСНЕННЯ ЕЛЕМЕНТІВ У БІНАРНИХ СПОЛУКАХ

Слайд 15ВИЗНАЧЕННЯ СТУПЕНІВ ОКИСНЕННЯ В КИСЛОТАХ, ГІДРОКСИДАХ ТА СОЛЯХ
ДЛЯ СПОЛУК, УТВОРЕНИХ БІЛЬШЕ

НІЖ ДВОМА ХІМІЧНИМИ ЕЛЕМЕНТАМИ, ПРИНЦИП ЕЛЕКТРОНЕЙТРАЛЬНОСТІ ТАКОЖ Є ОСНОВНИМ.
ПІДХІД ДЛЯ ВИЗНАЧЕННЯ СТУПЕНІВ ОКИСНЕННЯ ТАКИЙ САМИЙ, ЯК І ДЛЯ БІНАРНИХ СПОЛУК.
ТАКОЖ СЛІД ПАМ’ЯТАТИ, ЩО В ПЕРЕВАЖНІЙ БІЛЬШОСТІ СПОЛУК СТУПІНЬ ОКИСНЕННЯ ОКСИГЕНУ ДОРІВНЮЄ –2, А ГІДРОГЕНУ — +1.
Слайд 16АЛГОРИТМ ВИЗНАЧЕННЯ СТУПЕНІВ ОКИСНЕННЯ ЕЛЕМЕНТІВ У КИСЛОТАХ ТА ГІДРОКСИДАХ

Слайд 17ПРИКЛАД:
РОЗГЛЯНЕМО, ЯК ВИЗНАЧИТИ СТУПЕНІ ОКИСНЕННЯ ТРЬОХ ЕЛЕМЕНТІВ, НА ПРИКЛАДІ КАЛІЙ СУЛЬФІТУ K2SO3.

СТУПІНЬ ОКИСНЕННЯ КАЛІЮ У СПОЛУКАХ МОЖЕ БУТИ ТІЛЬКИ +1, А ОКСИГЕНУ — –2:
ОСКІЛЬКИ СУМА ЗАРЯДІВ МАЄ ДОРІВНЮВАТИ НУЛЮ, ТО ОБЧИСЛИМО СТУПІНЬ ОКИСНЕННЯ СУЛЬФУРУ, РОЗВ’ЯЗАВШИ РІВНЯННЯ:
2 · (+1) + 1 · (Х) + 3 · (–2) = 0, ЗВІДКИ Х = +4
Слайд 18СКЛАДАННЯ ФОРМУЛ СПОЛУК ЗА СТУПЕНЕМ ОКИСНЕННЯ ЕЛЕМЕНТІВ
ВИКОРИСТОВУЮЧИ СТУПЕНІ ОКИСНЕННЯ, СКЛАДАТИ ФОРМУЛИ

БІНАРНИХ СПОЛУК ПРОСТІШЕ, НІЖ ЗА ВАЛЕНТНІСТЮ.
СКЛАДАЮЧИ ФОРМУЛИ, СЛІД КЕРУВАТИСЯ ПРАВИЛОМ ЕЛЕКТРОНЕЙТРАЛЬНОСТІ:
ОСКІЛЬКИ БУДЬ-ЯКА РЕЧОВИНА Є ЕЛЕКТРОНЕЙТРАЛЬНОЮ, ТО СУМА СТУПЕНІВ ОКИСНЕННЯ АТОМІВ УСІХ ЕЛЕМЕНТІВ, З ЯКИХ СКЛАДАЄТЬСЯ РЕЧОВИНА, МАЄ ДОРІВНЮВАТИ НУЛЮ.
Слайд 19АЛГОРИТМ СКЛАДАННЯ ФОРМУЛ СПОЛУК ЗА ВІДОМИМИ СТУПЕНЯМИ ОКИСНЕННЯ ЕЛЕМЕНТІВ



















 Линейные алгоритмы и их реализация на языке программирования Pascal
Линейные алгоритмы и их реализация на языке программирования Pascal Графический интерфейс устройства. Шрифты и работа с текстом
Графический интерфейс устройства. Шрифты и работа с текстом Машинное обучение практика
Машинное обучение практика Информационные технологии в гостиничном бизнесе
Информационные технологии в гостиничном бизнесе Лекция. Презентации
Лекция. Презентации Мой инструмент компьютер
Мой инструмент компьютер Поиск информации
Поиск информации Алгоритм и его свойства
Алгоритм и его свойства Искусство оформления книги
Искусство оформления книги ACM-W Supporting, celebrating and advocating for Women in Computing
ACM-W Supporting, celebrating and advocating for Women in Computing Линии связи
Линии связи Техническое обслуживание и ремонт системы пожарной сигнализации
Техническое обслуживание и ремонт системы пожарной сигнализации Презентация на тему Структуры данных таблицы
Презентация на тему Структуры данных таблицы  Медиатекст: дефиниция, основные свойства, типология
Медиатекст: дефиниция, основные свойства, типология Protection or Abstinence в RFC 4041. Задание на самостоятельную подготовку к контрольной работе
Protection or Abstinence в RFC 4041. Задание на самостоятельную подготовку к контрольной работе Электронный документ и файл
Электронный документ и файл Generation of the 21st century
Generation of the 21st century ЛЕК Т- - копия
ЛЕК Т- - копия Перспективные направления развития теории сложных систем
Перспективные направления развития теории сложных систем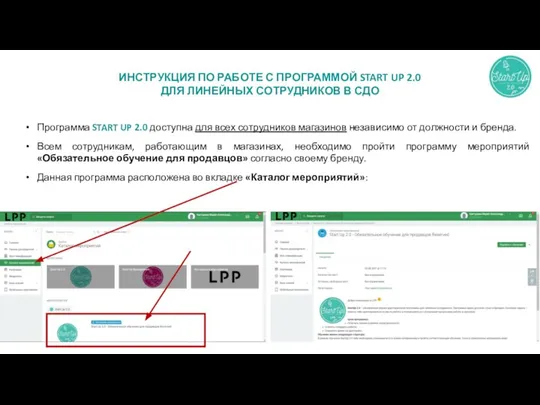 Инструкция по работе с программой start UP 2.0
Инструкция по работе с программой start UP 2.0 Заказ запчасти не из-под сервисной заявки в Хайер. Как заказать по коду продукта
Заказ запчасти не из-под сервисной заявки в Хайер. Как заказать по коду продукта Геоинформационные системы
Геоинформационные системы Activity. Объектно - ориентированное программирование
Activity. Объектно - ориентированное программирование Independent and parallel visual processing of ensemble statistics: Evidence from dual tasks
Independent and parallel visual processing of ensemble statistics: Evidence from dual tasks Закраска рисунков
Закраска рисунков Моделирование в среде табличного процессора. Расчёт геометрических параметров объекта
Моделирование в среде табличного процессора. Расчёт геометрических параметров объекта Подготовка слайдовой презентации в учебном процессе
Подготовка слайдовой презентации в учебном процессе Алгоритм работы автозаказа
Алгоритм работы автозаказа