Окислительно – восстановительные реакции Опорные понятия теории ОВР. Опорные понятия теории ОВР. Частицы, отдающие электроны – в
Содержание
- 2. Окислительно – восстановительные реакции
- 4. Опорные понятия теории ОВР. Частицы, отдающие электроны – восстановители. Частицы, принимающие электроны – окислители. Процесс отдачи
- 5. Задание №1. Какие из перечисленных ниже процессов представляют собой: окисление, а какие – восстановление. Определите число
- 6. Степень окисления.
- 7. Степень окисления - условный заряд, равный числу смещённых электронов от атома одного элемента к атому другого
- 8. Степень окисления изолированных атомов равна 0 Степень окисления простых веществ равна 0 Степень окисления водорода равна
- 9. Степень окисления фтора в соединениях равна -1 Степень окисления щелочных Ме в соединении равна +1 Степень
- 10. Степень окисления щелочноземельных Ме и Mg в соединениях равна +2 Высшая положительная степень окисления большинства элементов
- 11. Как определить степень окисления?
- 15. Задание №1 Определите степени окисления элементов в соединениях, формулы которых: KMnO4; HClO3; KAsO2; Na2CrO4
- 16. Задание №1 Определите степени окисления элементов в соединениях, формулы которых: K+1Mn+7O4-2; H+1Cl+3O3-2; K+1As+3O2-2; Na2+1Cr+6O4-2
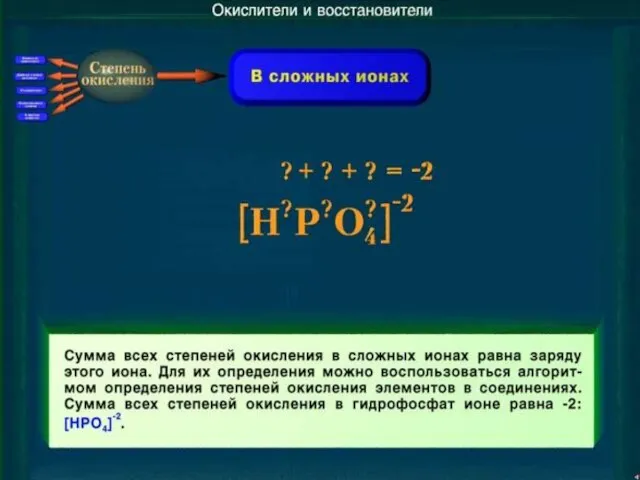
- 18. Задание №2. Определите степени окисления элементов в ионах: (Cr2O7)2-; (SO3)2-; (NH4)+; (AsO4)3-; (P2O7)4-
- 19. Задание №2. Определите степени окисления элементов в ионах: (Cr2+6O7-2)2-; (S+4O3-2)2-; (N-3H4+)+; (As+5O4-2)3-; (P2+5O7-2)4-
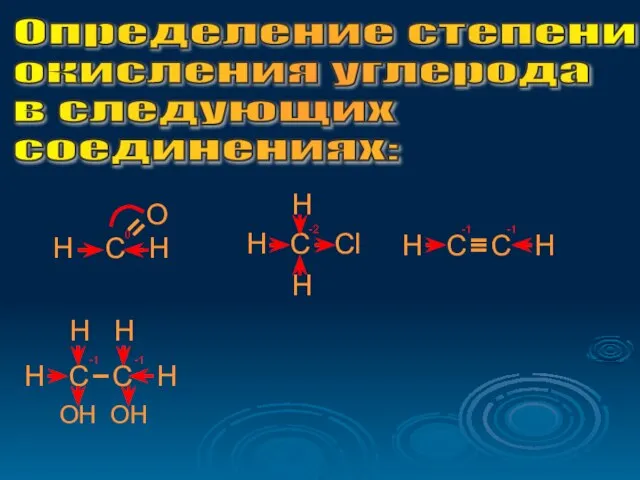
- 20. Определение степени окисления углерода в следующих соединениях: O H C H 0 H C Cl H
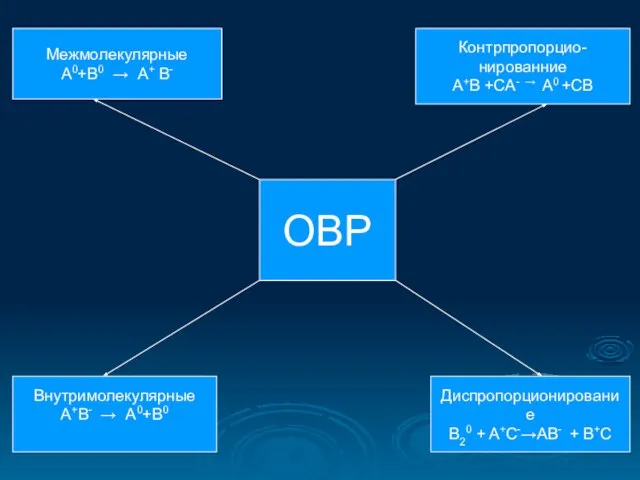
- 21. Классификация окислительно-восстановительных реакций
- 22. ОВР Межмолекулярные А0+В0 → А+ В- Контрпропорцио- нированние A+B +CA- → A0 +CB Внутримолекулярные А+В- →
- 23. Задание К какому типу ОВР относятся реакции, уравнения которых: 1.KMn+7O4-2 K2Mn+6O4 + Mn+4O2+ O20 2.H2S-2 +
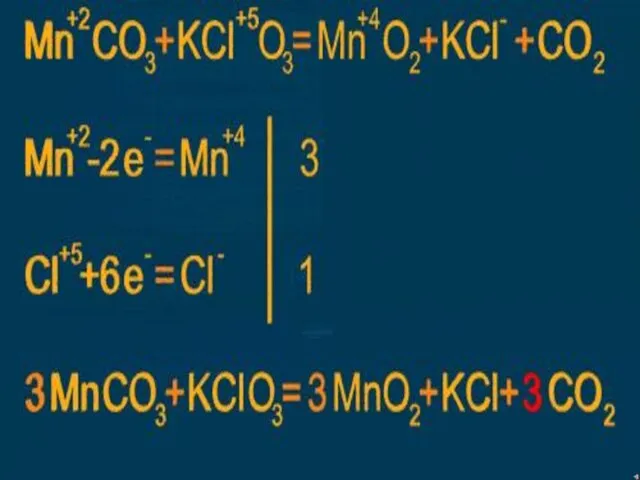
- 24. Расстановка коэффициентов в ОВР методом электронного баланса.
- 28. А что в ЕГЭ? Используя метод электронного баланса, составьте уравнение реакции: SO2 + K2Cr2O7 + …
- 30. Скачать презентацию























 Презентация на тему Формирование познавательной активности детей через экологическое воспитание: теория и практика
Презентация на тему Формирование познавательной активности детей через экологическое воспитание: теория и практика My England
My England Проект переработки творожной сыворотки в ООО Молоко п. Торбеево
Проект переработки творожной сыворотки в ООО Молоко п. Торбеево Ing form or infinitive
Ing form or infinitive Адаптация систем менеджмента качества к требованиям новой версии стандарта ГОСТ Р ИСО 9001-2015
Адаптация систем менеджмента качества к требованиям новой версии стандарта ГОСТ Р ИСО 9001-2015 Гласные и согласные
Гласные и согласные Репродуктивные органы размножения у растений
Репродуктивные органы размножения у растений OneTouch Marketing Activity
OneTouch Marketing Activity Ангел на шпиле Петропавловского собора
Ангел на шпиле Петропавловского собора Презентация на тему Правила поведения при пожаре
Презентация на тему Правила поведения при пожаре  Фен. Косметический девичник
Фен. Косметический девичник Валютный рынок FOREX
Валютный рынок FOREX ДЕСЕРТЫ
ДЕСЕРТЫ фонтан на книжной полке
фонтан на книжной полке Тоннель
Тоннель Электромагнитные явления
Электромагнитные явления Проект«Возможно ли в наше время сохранение единого русского литературного языка?»
Проект«Возможно ли в наше время сохранение единого русского литературного языка?» Как РА найти веб-студию и не потерять клиента?
Как РА найти веб-студию и не потерять клиента? Генетика человека 11 класс
Генетика человека 11 класс Урок № 3 Сценография – особый вид художественного творчества
Урок № 3 Сценография – особый вид художественного творчества Как делать контрольную работу
Как делать контрольную работу Чем опасна толпа
Чем опасна толпа Брошюра для родителей. Наше творчество
Брошюра для родителей. Наше творчество Понятие коммуникационного процесса. Модель коммуникации лассуэла
Понятие коммуникационного процесса. Модель коммуникации лассуэла Химическое многоборье
Химическое многоборье 菲奥娜和史莱克
菲奥娜和史莱克 Россия и страны бывшего СССР: если интегрироваться, то с кем?
Россия и страны бывшего СССР: если интегрироваться, то с кем? «Нестандартные формы работы на уроках литературы в условиях внедрения инновационных методов»
«Нестандартные формы работы на уроках литературы в условиях внедрения инновационных методов»