Слайд 2ОРИГИНАЛЬНЫЙ ПРЕПАРАТ
Лекарственный препарат, первым получившим разрешение на продажу (обычно как патентованный препарат)

на основании документации об эффективности, безопасности в соответствии с действующими требованиями на момент регистрации (в стране производителе, FDA, EMEA)
Должен соответствовать GMP, GLP, GCP
Слайд 3ДЖЕНЕРИК
Препарат конкретного производителя, существенно схожий с оригинальным продуктом, представленный в той же

лекарственной форме и имеющий тот же качественный и количественный состав активных ингредиентов, как и оригинальный продукт, и должен быть ему биоэквивалентным.
Слайд 4ДЖЕНЕРИК (ВОЗ)
Два фармацевтических продукта биоэквивалентны, если они эквивалентны фармацевтически и параметры их

биодоступности (скорость и степень доступности) после введения в одинаковой молярной дозе сходны в такой степени, которая позволяет предполагать, что их воздействие будет по существу одинаковым
Слайд 5ДЖЕНЕРИК
(Фармакологический комитет РФ)
Два лекарственных препарата являются биоэквивалентными, если они обеспечивают

одинаковую биодоступность лекарственного средства.
А как быть с препаратами вводимыми парентерально, ингаляционно?
Слайд 6БИОЭКВИВАЛЕНТНОСТЬ (FDA)
В правилах определения биоэквивалентности, разработанных FDA, большое внимание уделяется дизайну исследования.

Дизайн проводиться двойным слепым перекрестным методом парного сравнения АВ\ВА. Изучается как эффект от однократного введения препарата, так и влияния длительной терапии.
Учитывается не только поступление препарата, но и его выведение
Исследования проводятся в независимых лабораториях.
Слайд 7БИОЭКВИВАЛЕНТНОСТЬ (ФК РФ)
Открытая рандомизированная перекрестная схема при однократном приеме фармакологического препарата. Использование

однократного введения препаратов не позволяет оценить их биоэквивалентность при длительном применении для тех препаратов, для которых существенную роль в биологическом действии может иметь эффект накопления.
В рекомендациях ФК раздел «математическая статистика» отсутствует
Слайд 8Если есть данные по биоэквивалентности, изученной в соответствии со стандартами GCP, все

химические показатели (примеси), фармацевтические и производственные (GMP) соответствуют оригиналу, то специальных доказательств терапевтической эквивалентности не требуется.
А если этого нет, то кто должен проводить и оплачивать исследования?
Слайд 9ФОРМУЛЯРНАЯ СИСТЕМА
«Формулярная система» определяется как комплекс структур и управленческих мероприятий в здравоохранении,

обеспечивающих применение рациональных, т.е. организационно и экономически эффективных методов снабжения и использования лекарственных средств с целью обеспечения максимально высокого с учетом конкретных условий качества медицинской помощи и оптимального использования имеющихся ресурсов
Слайд 10
Включение в формулярный перечень лечебного учреждения и закупка дженериков позволяет экономить

деньги
Слайд 11 Если препарат зарегистрирован Фармакологическим комитетом РФ, то юридически он соответствует оригинальному

препарату.
Что делать?
Как защитить свое решение по выбору дженерика?
Только ли цена определяет выбор?
Если выберем самое дешевое, сэкономим ли деньги?
Слайд 12Территориальный перечень Республики Карелия
На основе списка жизненно необходимых препаратов, разработанных стандартов и

российских рекомендации обществ специалистов
На основе принципов доказательной медицины
Согласован с руководителями рабочих групп
Утвержден главой правительства Республики Карелия
Слайд 13Территориальный перечень Республики Карелия
По международным непатентованным наименованиям
Указаны формы выпуска (если необходимой нет,

в свой формуляр можно включить)
Нет указаний на торговые наименования и дозы
Пересматривается 1 раз в год
Слайд 14Формуляры лечебных учреждений
МНН и торговые наименования, формы выпуска и дозы.

Слайд 15Отдел лекарственного обеспечения и клинической фармакологии Республиканской больницы Республики Карелия
Что покупать

– оригинальные препараты или дженерики? Если дженерики, то что выбрать?
Решение о применении генерических, так же как и оригинальных препаратов должно приниматься в соответствии с принципами доказательной медицины, с учетом данных фармакохимического анализа (определение примесей), которые могут оказывать влияние на биодоступность препарата и данных о биоэквивалентности препарата, в соответствии со стандартами GCP
Слайд 16 При включении в формуляр Республиканской больницы дженерика:
Данные по проведению исследований на

биоэквивалентность (дизайн исследования, полный протокол, место проведения, сравнение с оригиналом)
В 50% случаев данные не представляются вообще (информации нет у фирмы производителя)
Слайд 17 Формуляр Республиканской больницы (основа для закупок)
25% - оригинальные препараты (если нет

генерических замен, антимикробная терапия тяжелых инфекций, лекарственные препараты для онкогематологии)
75% - дженерики (выбор на основании предъявляемых данных по биоэквивалентности)
Слайд 18 Формуляр Республиканской больницы (основа для закупок)
В формулярном перечне (в том числе

при формировании заявки) указывается несколько торговых наименований, иногда и оригинальное)
Закупается, то что на аукционе дешевле
Например:
Рамиприл (хартил, амприлан, тритаце)
Были ситуации, когда у дистрибьютера цена на тритаце оказалась дешевле
Если дистрибьютер представляет торговое наименование, которого нет в формуляре, как правило у него нет данных по биоэквивалентности

















 Моделирование пенсионной системы России
Моделирование пенсионной системы России Образ Петра I в творчестве М.В. Ломоносова
Образ Петра I в творчестве М.В. Ломоносова Буквы о- а- в корнях рос раст ращ
Буквы о- а- в корнях рос раст ращ Urok_157-159_Napolnoe_soderzhanie_broylerov
Urok_157-159_Napolnoe_soderzhanie_broylerov План реализации проекта
План реализации проекта РАЗВИТИЕ ПАРТНЕРСКИХ ОТНОШЕНИЙ В ОБЛАСТИ ЖИЛИЩНОГО КРЕДИТОВАНИЯ
РАЗВИТИЕ ПАРТНЕРСКИХ ОТНОШЕНИЙ В ОБЛАСТИ ЖИЛИЩНОГО КРЕДИТОВАНИЯ Микрофлюидные МЭМС. Сенсоры для биологических и медицинских микросистем. Микронасосы. Персональный мониторинг здоровья
Микрофлюидные МЭМС. Сенсоры для биологических и медицинских микросистем. Микронасосы. Персональный мониторинг здоровья Welcome to Krasnoyarsk
Welcome to Krasnoyarsk Технология приготовления блинов и блинчиков
Технология приготовления блинов и блинчиков Елочные игрушки
Елочные игрушки Создание аксессуаров с использованием лоскутных техник
Создание аксессуаров с использованием лоскутных техник Презентация на тему Пресноводные рыбы
Презентация на тему Пресноводные рыбы Бабушка плюшевого медвежонка
Бабушка плюшевого медвежонка Памятники деревянного зодчества в Марийском крае.
Памятники деревянного зодчества в Марийском крае. Реализация профильного обучения математике в условиях сельской школы.
Реализация профильного обучения математике в условиях сельской школы. Презентация на тему Я талантлив
Презентация на тему Я талантлив Вакцины от ВПЧ. Конкурентная борьба и стратегия работы врача женской консультации.Нужна ли нам государственная программа вакцина
Вакцины от ВПЧ. Конкурентная борьба и стратегия работы врача женской консультации.Нужна ли нам государственная программа вакцина Курсы критического мышления. Школа лидерства
Курсы критического мышления. Школа лидерства Тренировка памяти
Тренировка памяти Правописание Н и НН в суффиксах имен прилагательных
Правописание Н и НН в суффиксах имен прилагательных Культура и мораль
Культура и мораль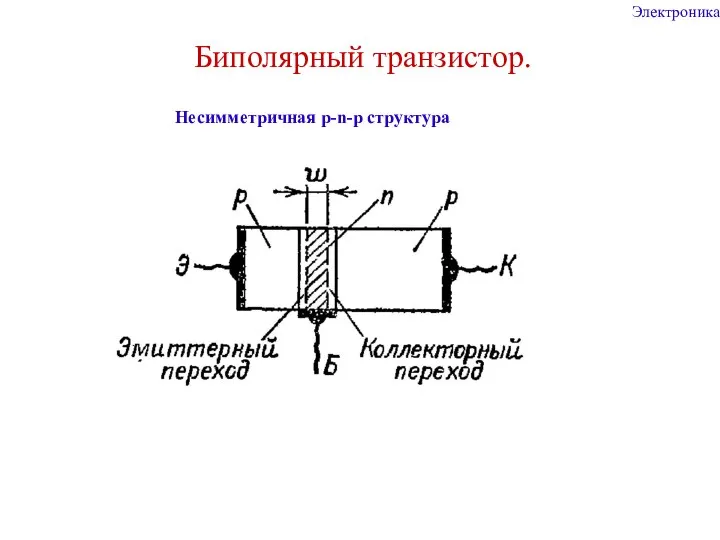 Электроника. Биполярный транзистор. Несимметричная p-n-p структура
Электроника. Биполярный транзистор. Несимметричная p-n-p структура Weihenstephan-Triesdorf University of Applied Sciences
Weihenstephan-Triesdorf University of Applied Sciences Стадии развития насекомого (3 класс)
Стадии развития насекомого (3 класс) Make up the names of animals tlephane kemony figrafe noli rohse xof tac lecrodico lowf reab regti ribtab ribd ogd.
Make up the names of animals tlephane kemony figrafe noli rohse xof tac lecrodico lowf reab regti ribtab ribd ogd. Основы организации локальных сетей Лекция 12 Тенденции развития локальных сетей Ethernet кандидат технических наук, доцент Новиков
Основы организации локальных сетей Лекция 12 Тенденции развития локальных сетей Ethernet кандидат технических наук, доцент Новиков  Пейзаж
Пейзаж РЕАЛИЗАЦИЯ ОРТОПЕДИЧЕСКИХ ИЗДЕЛИЙ В ПРЕМИАЛЬНОМ СЕГМЕНТЕ РЫНКА. - презентация
РЕАЛИЗАЦИЯ ОРТОПЕДИЧЕСКИХ ИЗДЕЛИЙ В ПРЕМИАЛЬНОМ СЕГМЕНТЕ РЫНКА. - презентация