Содержание
- 2. Методы, используемые в биологической химии Биохимия на всем протяжении своего раз- вития была и остается экспериментальной
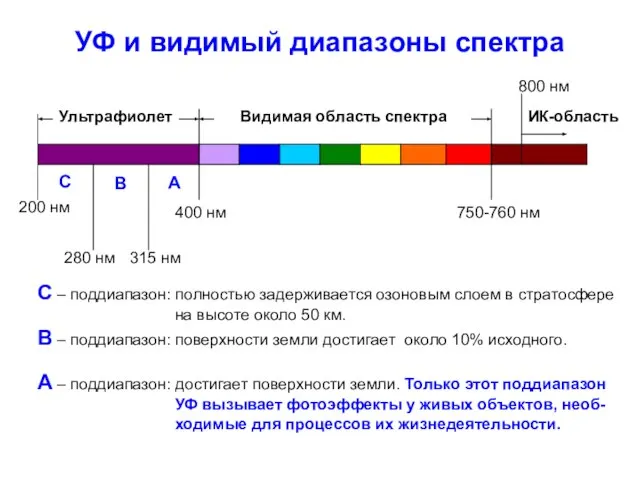
- 3. УФ и видимый диапазоны спектра Видимая область спектра ИК-область Ультрафиолет 400 нм 750-760 нм 200 нм
- 4. Абсорбционная спектроскопия в УФ и видимой областях спектра служит для: Высокочувствительного качественного анализа сложных смесей веществ.
- 5. Энергия любого вида электромагнитного излучения (в том числе и светового) поглощается и излучается отдельными порциями. Эти
- 6. Взаимодействие кванта (фотона) с веществом Квант светового излучения не взаимодействует с веществом. При этом энергия кванта
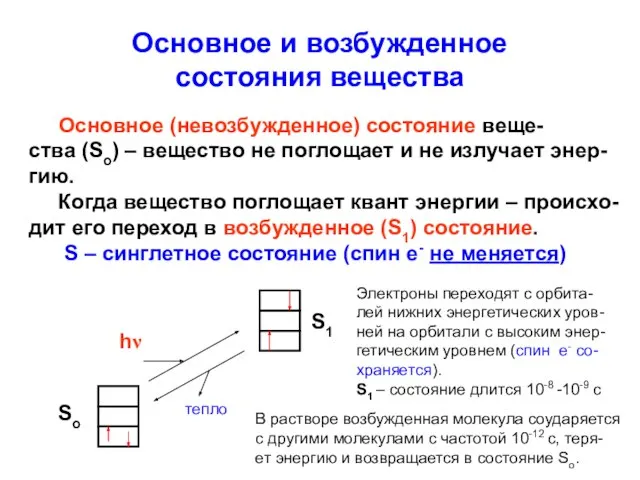
- 7. Основное и возбужденное состояния вещества Основное (невозбужденное) состояние веще- ства (So) – вещество не поглощает и
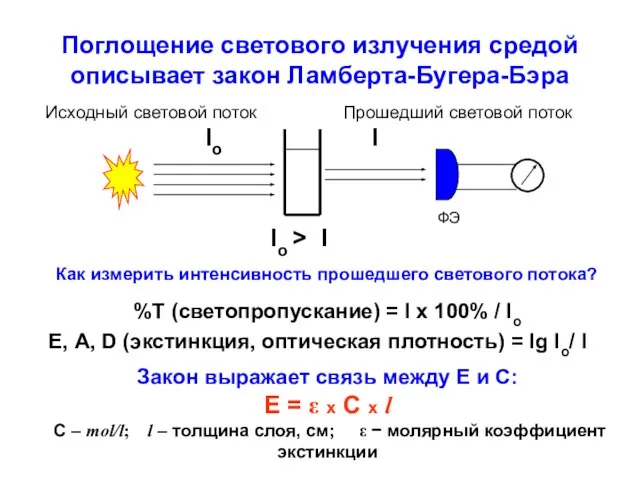
- 8. Поглощение светового излучения средой описывает закон Ламберта-Бугера-Бэра ФЭ Io I Io > I %T (светопропускание) =
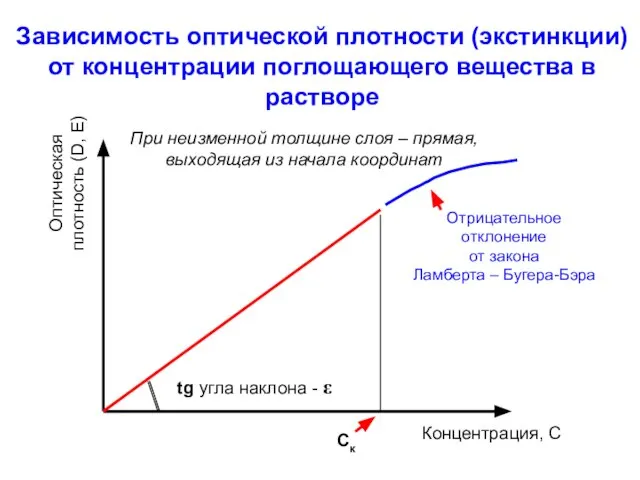
- 9. Зависимость оптической плотности (экстинкции) от концентрации поглощающего вещества в растворе Оптическая плотность (D, E) Концентрация, С
- 10. Основные причины отклонений от закона Ламберта – Бугера-Бэра реакции ассоциации, диссоциации или химичес- кие взаимодействия соединения
- 11. немонохроматичность падающего на образец света (Io) при большой ширине спектральной щели. При этом могут быть существенные
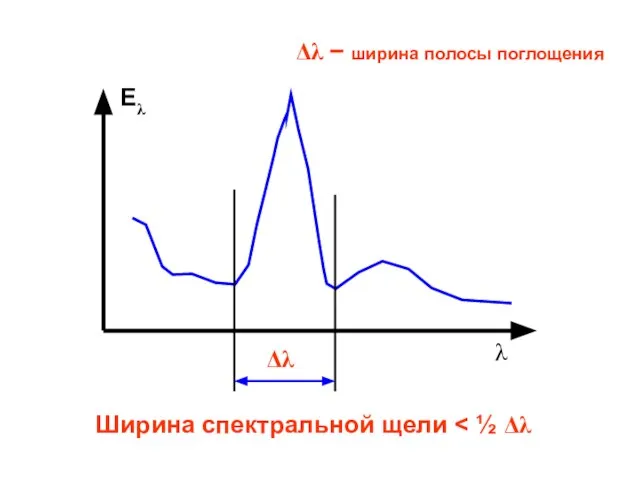
- 12. Eλ λ Δλ Ширина спектральной щели Δλ − ширина полосы поглощения
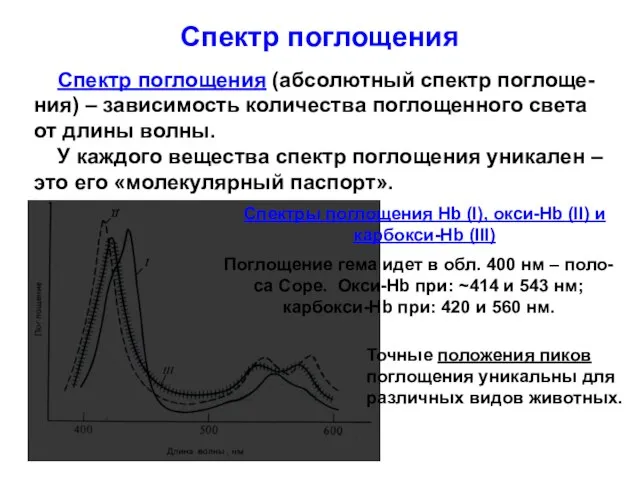
- 13. Спектр поглощения Спектр поглощения (абсолютный спектр поглоще-ния) – зависимость количества поглощенного света от длины волны. У
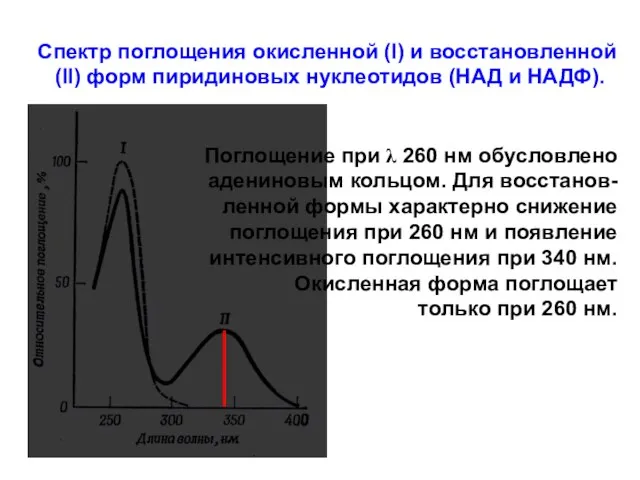
- 14. Спектр поглощения окисленной (I) и восстановленной (II) форм пиридиновых нуклеотидов (НАД и НАДФ). Поглощение при λ
- 15. Аппаратура для абсорбционной спектроскопии Фотоколориметр (фотометр, колориметр): Единственный источник света Спектральный диапазон: λ 315 – 700
- 16. Область применения абсорбционной спектроскопии: Измерение С вещества в растворе (количественный анализ); 2. Регистрация течения химических превращений;
- 17. ФЛУОРЕСЦЕНТНАЯ СПЕКТРОСКОПИЯ (ФЛУОРИМЕТРИЯ)
- 18. Флуориметрия Флуоресценция – испускание света молекулой, возбужденной световым излучением. (Свечение мо- лекул также можно инициировать химической
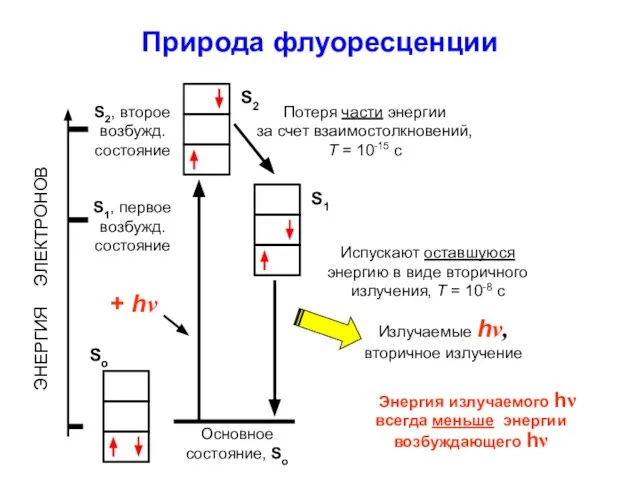
- 19. Природа флуоресценции ЭНЕРГИЯ ЭЛЕКТРОНОВ Основное состояние, So S1, первое возбужд. состояние S2, второе возбужд. состояние +
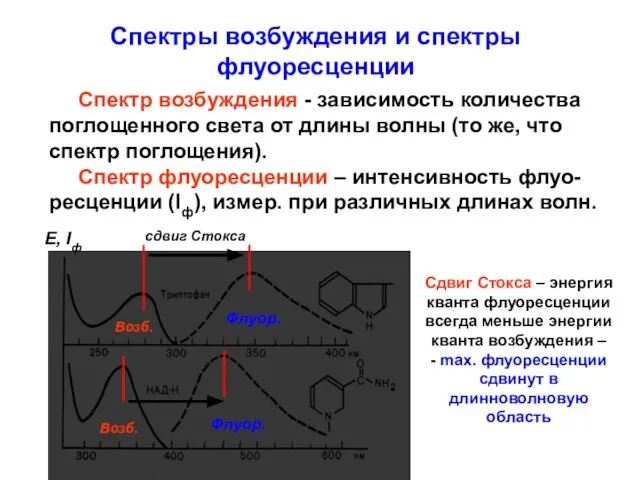
- 20. Спектры возбуждения и спектры флуоресценции Спектр возбуждения - зависимость количества поглощенного света от длины волны (то
- 21. Основные закономерности флуоресценции Флуоресценция происходит при любой длине волны возбуждающего света. 2. Q (квантовый выход флуоресценции):
- 22. Зависимость Iф от концентрации вещества Iф = Io x Q x C Io – интенсивность возбуждающего
- 23. Для того, чтобы в полной мере реализовать высо- кую чувствительность, свойственную флуориметрии, необходимо: возбуждать флуоресценцию при
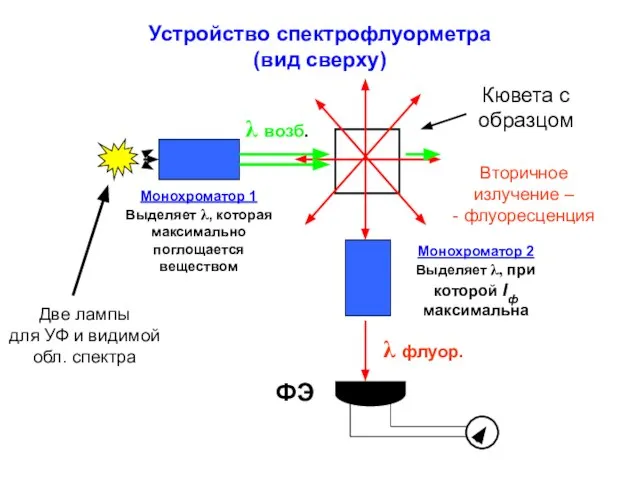
- 24. Устройство спектрофлуорметра (вид сверху) Монохроматор 1 Выделяет λ, которая максимально поглощается веществом Монохроматор 2 Выделяет λ,
- 25. Применение флуориметрии Высокочувствительный и высокоспецифичный количествен- ный анализ (в том числе, в энзимологии). Качественный анализ –
- 26. СВЕТОРАССЕИВАНИЕ
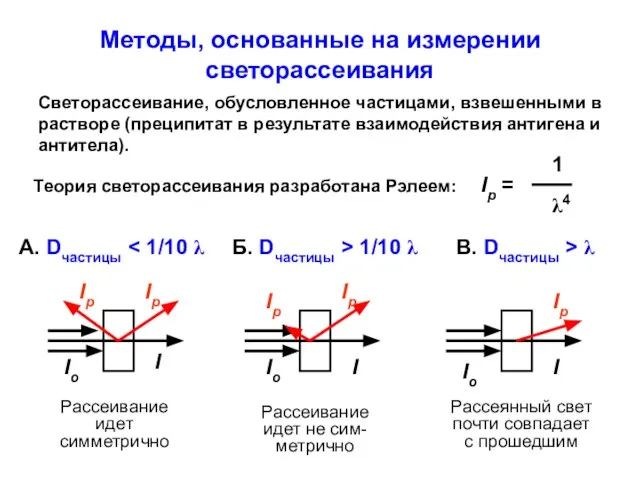
- 27. Методы, основанные на измерении светорассеивания Светорассеивание, обусловленное частицами, взвешенными в растворе (преципитат в результате взаимодействия антигена
- 28. Турбидиметрия (англ. «turbidity» – мутность). Метод основан на измерении интенсивности про-шедшего через образец (не рассеянного) света.
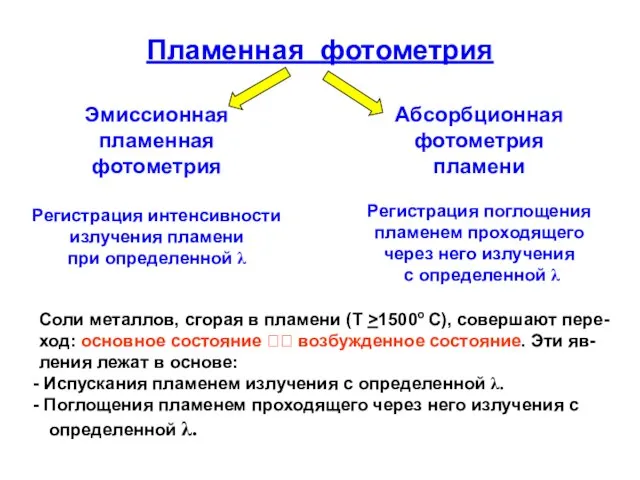
- 29. Пламенная фотометрия Эмиссионная пламенная фотометрия Регистрация интенсивности излучения пламени при определенной λ Абсорбционная фотометрия пламени Регистрация
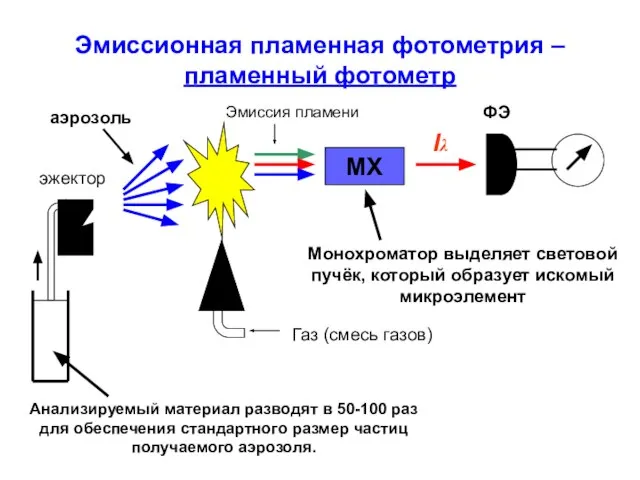
- 30. Эмиссионная пламенная фотометрия – пламенный фотометр МХ Газ (смесь газов) эжектор Iλ Анализируемый материал разводят в
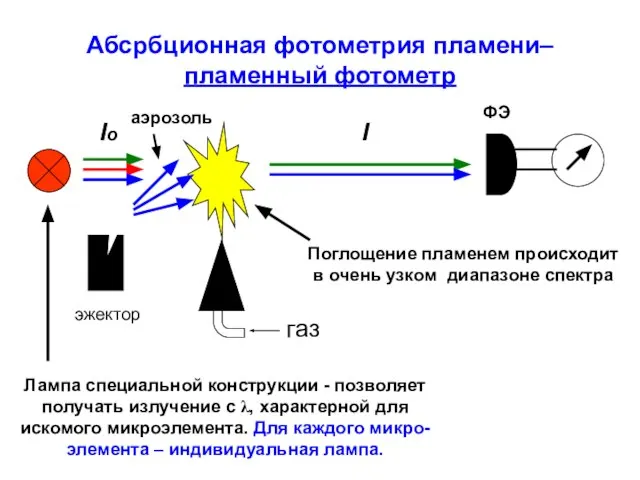
- 31. Абсрбционная фотометрия пламени– пламенный фотометр газ эжектор Iо аэрозоль Поглощение пламенем происходит в очень узком диапазоне
- 33. Скачать презентацию
















 Ход реализации пилотных проектов Росреестра на территории республики, а также создание региональной модели инфраструктуры прост
Ход реализации пилотных проектов Росреестра на территории республики, а также создание региональной модели инфраструктуры прост Пройдём с тобой по школьным этажам …
Пройдём с тобой по школьным этажам … Бал во дворце. Урок изобразительного искусства (5 класс)
Бал во дворце. Урок изобразительного искусства (5 класс) Биоинформатика
Биоинформатика Новоладожская детская школа искусств. Обучение детей росписи по ткани в технике холодного батика
Новоладожская детская школа искусств. Обучение детей росписи по ткани в технике холодного батика Кофейня «Blanco y negro»
Кофейня «Blanco y negro» ИНФОРМАЦИЯ О КОМПАНИИ
ИНФОРМАЦИЯ О КОМПАНИИ Презентация на тему Животный мир Арктики и Антарктиды
Презентация на тему Животный мир Арктики и Антарктиды  День полиции
День полиции Должностная инструкция
Должностная инструкция Подготовительные недели Великого Поста
Подготовительные недели Великого Поста Легко ли быть изобретателем?
Легко ли быть изобретателем? Итоговая аттестация выпускников старшей школы. ГОУСОШ №820
Итоговая аттестация выпускников старшей школы. ГОУСОШ №820 28-я Международная специализированная выставка Реклама 2021
28-я Международная специализированная выставка Реклама 2021 What are they wearing gtame
What are they wearing gtame Спешите стать терпимей и добрей
Спешите стать терпимей и добрей Презентация на тему Слово Предложение
Презентация на тему Слово Предложение Политическая система общества
Политическая система общества  Презентация на тему Любовная лирика Пушкина
Презентация на тему Любовная лирика Пушкина  «Алфавит - животные» (в загадках и картинках)
«Алфавит - животные» (в загадках и картинках) Палеозой
Палеозой Игра «Знатоки квадратных уравнений»
Игра «Знатоки квадратных уравнений» Ledeco – профессиональный партнер в сфере реализации инженерно-строительных проектов
Ledeco – профессиональный партнер в сфере реализации инженерно-строительных проектов дз
дз Риски информационной безопасности при передаче систем на аутсорсинг
Риски информационной безопасности при передаче систем на аутсорсинг Политический анализ
Политический анализ Штефан Кукс Stephan Kux Отдел Экономики Economic Development Кантон Цюрих Canton of Zurich
Штефан Кукс Stephan Kux Отдел Экономики Economic Development Кантон Цюрих Canton of Zurich  Стажировка в АО Сибур-Нефтехим (специалист планово-экономического отдела)
Стажировка в АО Сибур-Нефтехим (специалист планово-экономического отдела)