Содержание
- 2. Основное содержание лекции: Понятие о непредельных углеводородах. Характеристика двойной связи. Изомерия и номенклатура алкенов. Физические свойства.
- 3. Понятие об алкенах Алкены – углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а
- 4. Вид гибридизации – Валентный угол – Длина связи С = С – Строение ─ Вид связи
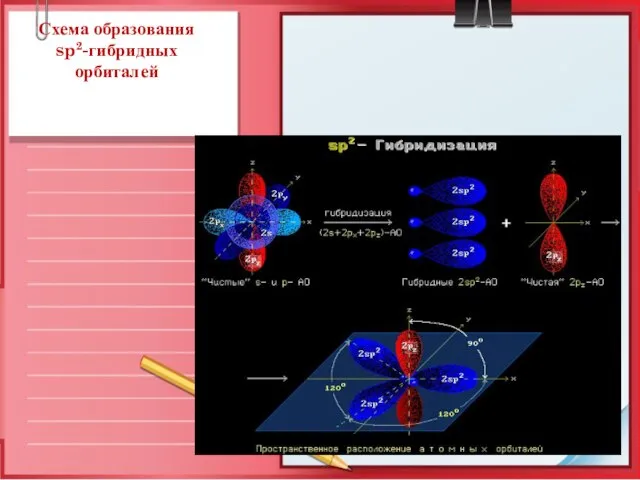
- 5. Схема образования sp2-гибридных орбиталей
- 6. Схема образования sp2-гибридных орбиталей
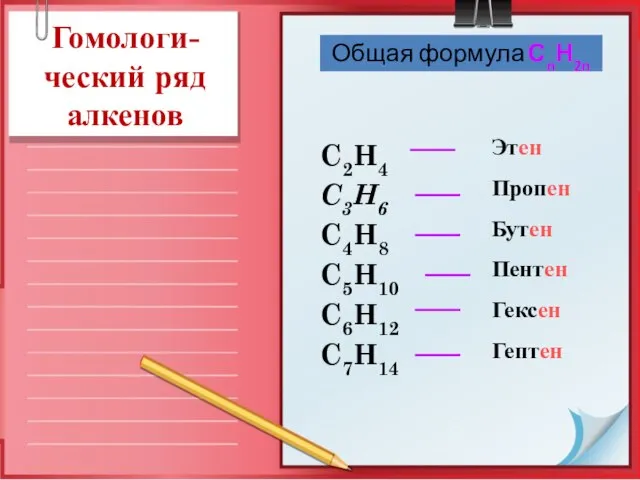
- 7. Этен Пропен Бутен Пентен Гексен Гептен C2H4 C3H6 C4H8 C5H10 C6H12 C7H14 Общая формула СnН2n Гомологи-ческий
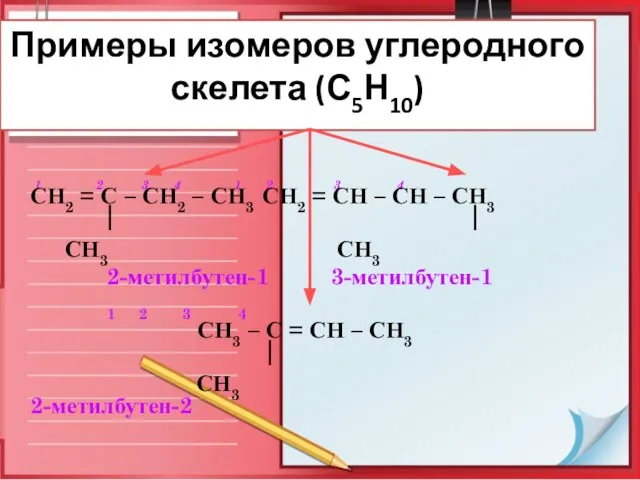
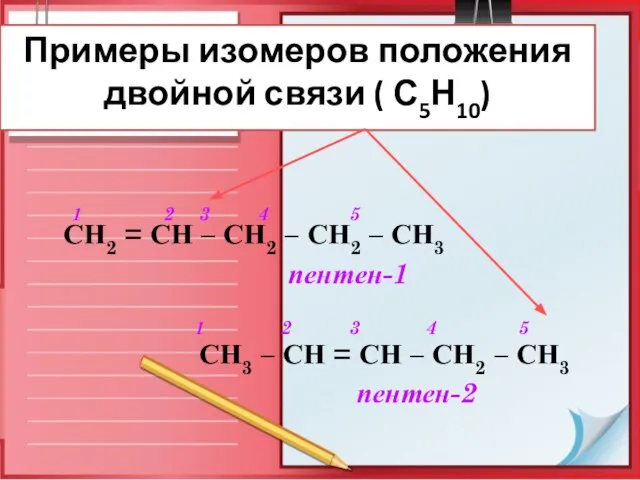
- 8. Изомерия алкенов Для алкенов возможны два типа изомерии: 1-ый тип – структурная изомерия: углеродного скелета положения
- 9. Примеры изомеров углеродного скелета (С5Н10) 1 2 3 4 1 2 3 4 СН2 = С
- 10. Примеры изомеров положения двойной связи ( С5Н10) 1 2 3 4 5 СН2 = СН –
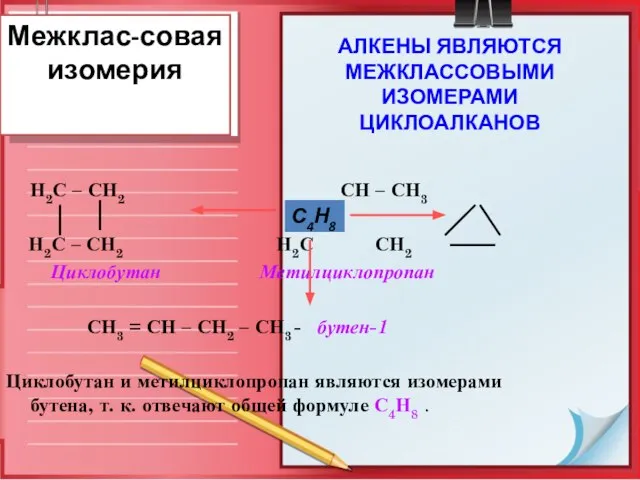
- 11. Межклас-совая изомерия Н2С – СН2 СН – СН3 Н2С – СН2 Н2С СН2 Циклобутан Метилциклопропан СН3
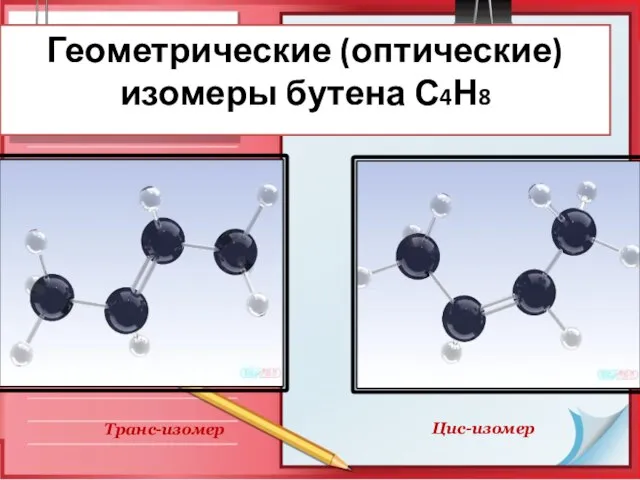
- 12. Геометрические (оптические) изомеры бутена С4Н8 Цис-изомер Транс-изомер
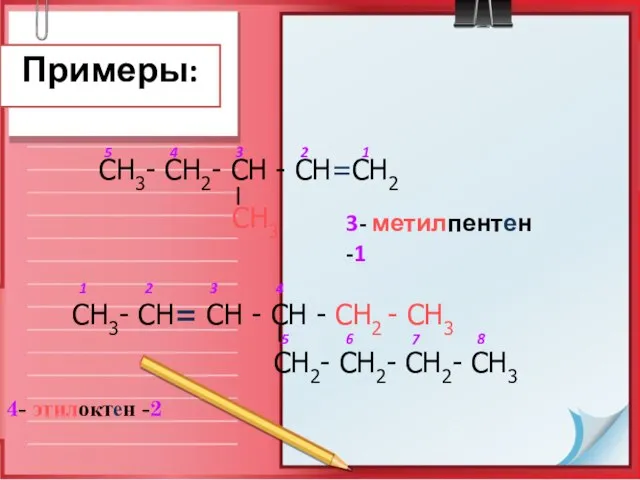
- 13. Примеры: 4- этилоктен -2 СН3- СН2- СН - СН=СН2 СН3 СН3- СН= СН - СН -
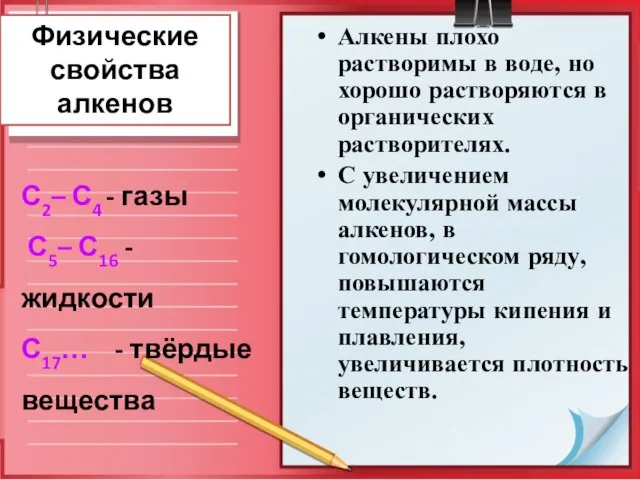
- 14. Физические свойства алкенов Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях. С увеличением
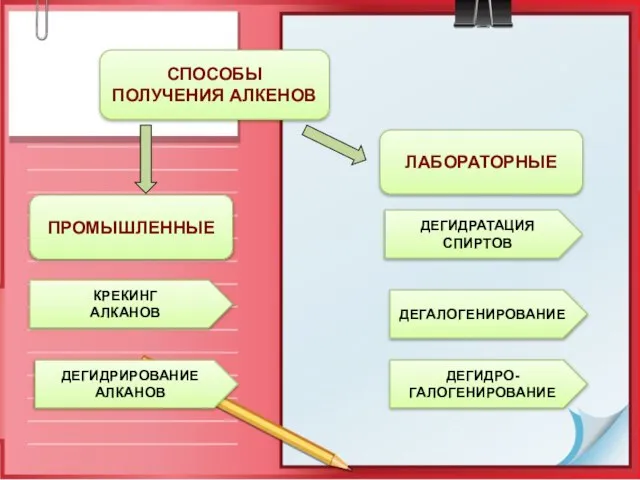
- 15. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИРОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ
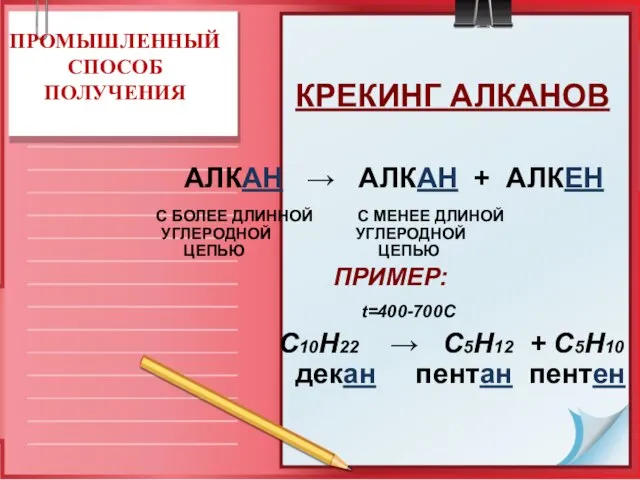
- 16. КРЕКИНГ АЛКАНОВ ПРИМЕР: t=400-700C С10Н22 → C5H12 + C5H10 декан пентан пентен ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ АЛКАН
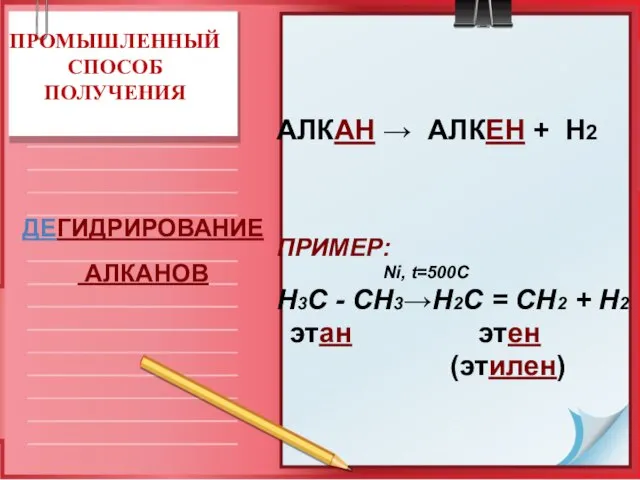
- 17. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ АЛКАН → АЛКЕН + Н2 ПРИМЕР: Ni, t=500C Н3С - СН3→Н2С = СН2
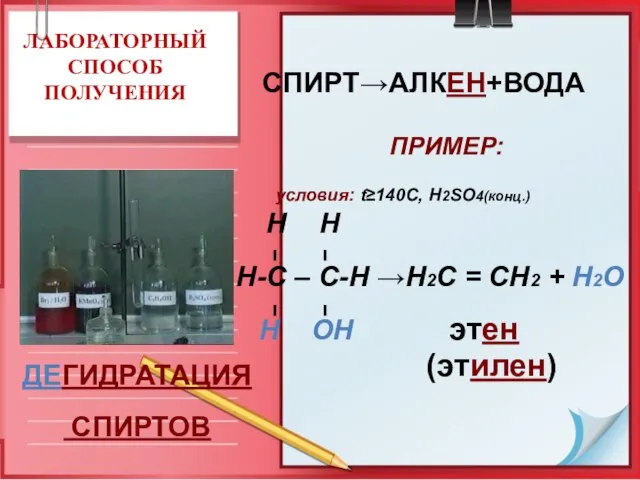
- 18. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ СПИРТ→АЛКЕН+ВОДА ПРИМЕР: условия: t≥140C, Н2SO4(конц.) Н Н Н-С – С-Н →Н2С = СН2
- 19. ЛАБОРАТОР-НЫЙ СПОСОБ ПОЛУЧЕНИЯ ПРИМЕР: t Н2С – СН2 + Zn → Н2С = СН2 + ZnBr2
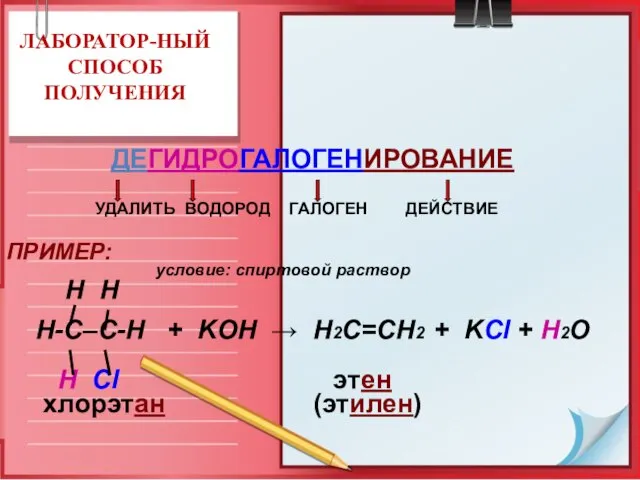
- 20. ЛАБОРАТОР-НЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: условие: спиртовой раствор H H Н-С–С-Н +
- 21. Механизм реакций присоедине-ния алкенов Электрофильное присоединение: разрыв π-связи протекает по гетеролитическому механизму, если атакующая частица является
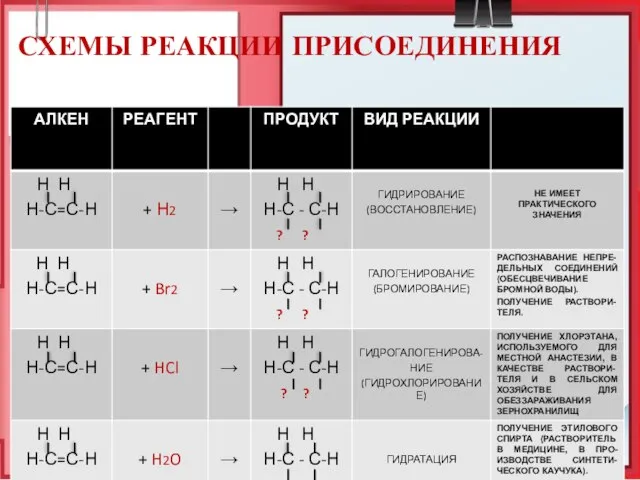
- 22. СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ
- 23. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Это процесс соединения одинаковых молекул в более крупные. ПРИМЕР: n CH2=CH2 (-CH2-CH2-)n этилен полиэтилен
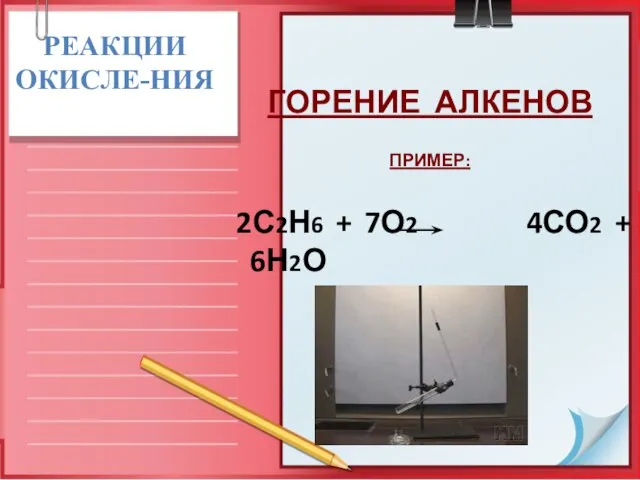
- 24. РЕАКЦИИ ОКИСЛЕ-НИЯ ГОРЕНИЕ АЛКЕНОВ ПРИМЕР: 2С2Н6 + 7О2 4СО2 + 6Н2О
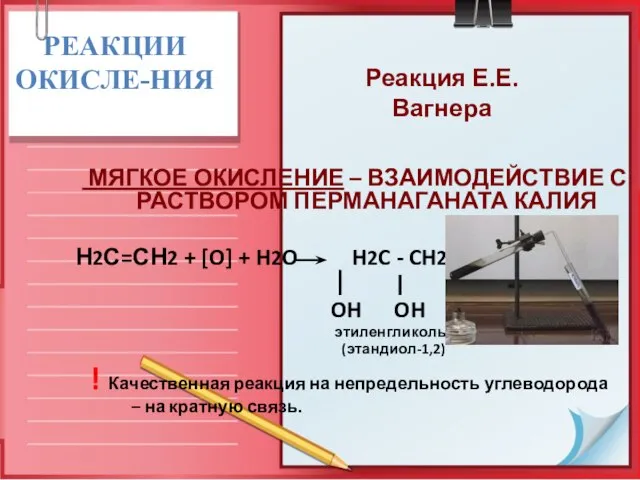
- 25. РЕАКЦИИ ОКИСЛЕ-НИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ Н2С=СН2 + [O] + H2O H2C
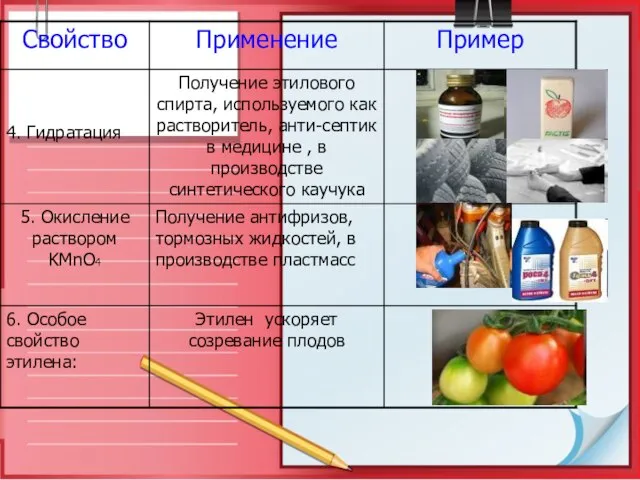
- 26. Применение этилена
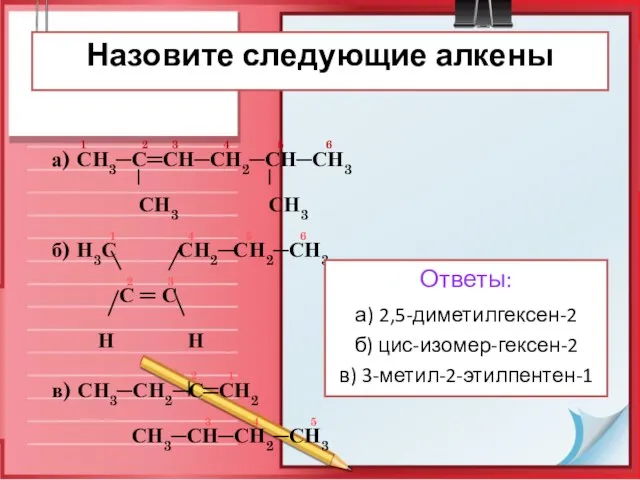
- 28. 1 2 3 4 5 6 а) СН3─С═СН─СН2─СН─СН3 СН3 СН3 1 4 5 6 б) Н3С
- 29. а) СН3-СН=СН2 + НСl → ? б) СН2=СН-СН2-СН3 + НBr → ? В) СН3-СН2-СН=СН2 + НОН
- 30. ДОМАШНЕЕ ЗАДАНИЕ Оценка «3»: параграф 4, ТПО стр. 24-25, № 5-7 Оценка «4»: Хомченко И.Г.: 20.21
- 32. Скачать презентацию











 Встречают по одежке. Искусство самопрезентации. Бренд МногоМама
Встречают по одежке. Искусство самопрезентации. Бренд МногоМама Устройства вы́вода информации
Устройства вы́вода информации Психоаналитическая теория сновидений
Психоаналитическая теория сновидений Пустыни и полупустыни России
Пустыни и полупустыни России Лексическая сочетаемость
Лексическая сочетаемость Отец света и небесный кузнец Сварог
Отец света и небесный кузнец Сварог Марки акцизного сбора
Марки акцизного сбора Способ управления и назначение
Способ управления и назначение Направление «Информатика и вычислительная техника»
Направление «Информатика и вычислительная техника» Способы получения и утраты гражданства Израиля
Способы получения и утраты гражданства Израиля Творчество В. М. Васнецова, М. А. Врубеля, М.В. Нестерова. История искусства. Часть 17
Творчество В. М. Васнецова, М. А. Врубеля, М.В. Нестерова. История искусства. Часть 17 Пленарное заседание ИСО ТК67 Сентябрь, 14-15Москва Балчуг Кемпински
Пленарное заседание ИСО ТК67 Сентябрь, 14-15Москва Балчуг Кемпински Федеративное устройство. Федеральные органы власти. 10 класс
Федеративное устройство. Федеральные органы власти. 10 класс Презентация на тему Характеристика и классификация услуг
Презентация на тему Характеристика и классификация услуг Равномерное и равноускоренное движение
Равномерное и равноускоренное движение Нарушения водно-электролитного обмена
Нарушения водно-электролитного обмена Свифт Приключения Гулливера
Свифт Приключения Гулливера Презентация на тему Составление портрета хитрого человека в художественном стиле.
Презентация на тему Составление портрета хитрого человека в художественном стиле. Комплексный маркетинг для бизнеса
Комплексный маркетинг для бизнеса Маркетинговое обоснование модели среднестатистического покупателя и ее влияния на качество обслуживания в аптечных организациях
Маркетинговое обоснование модели среднестатистического покупателя и ее влияния на качество обслуживания в аптечных организациях Guess the animal. Using the shadow
Guess the animal. Using the shadow Барокко. Краткая история
Барокко. Краткая история Особенности проектного финансирования в реальном секторе экономики
Особенности проектного финансирования в реальном секторе экономики Презентация на тему Склонение имен прилагательных мн ч
Презентация на тему Склонение имен прилагательных мн ч  Замена светильников в гарантийный период
Замена светильников в гарантийный период Презентация на тему Массаж
Презентация на тему Массаж  Роль краеведения в воспитании патриотизма
Роль краеведения в воспитании патриотизма Лабиринт знаний - презентация для начальной школы_
Лабиринт знаний - презентация для начальной школы_