Содержание
- 2. Положение неметаллов в ПС Д.И.Менделеева. Неметаллы расположены в правом верхнем углу ПС (вдоль и над диагональю
- 3. Особенности атомного строения элементов-неметаллов. Для атомов-неметаллов характерно: Небольшой атомный радиус ( в сравнении с радиусами атомов-металлов
- 4. Характеристика простых веществ-неметаллов. Для неметаллов - простых веществ более характерно различие свойствах (физических и химических), чем
- 5. Физические свойства простых веществ – неметаллов. Для неметаллов (простых веществ) характерны все 3 агрегатных состояния при
- 6. Для неметаллов характерна разнообразная цветовая гамма: белый ,черный ,красный фосфор, красно-бурый бром, желтая сера, фиолетовый йод,
- 7. Аллотропия. Среди неметаллов распространено явление аллотропии. Один элемент может образовывать несколько простых веществ. Причины аллотропии: Разные
- 8. Кислород О2 и озон О3 Кислород- газ, без цвета, вкуса и запаха, плохо растворим в воде,
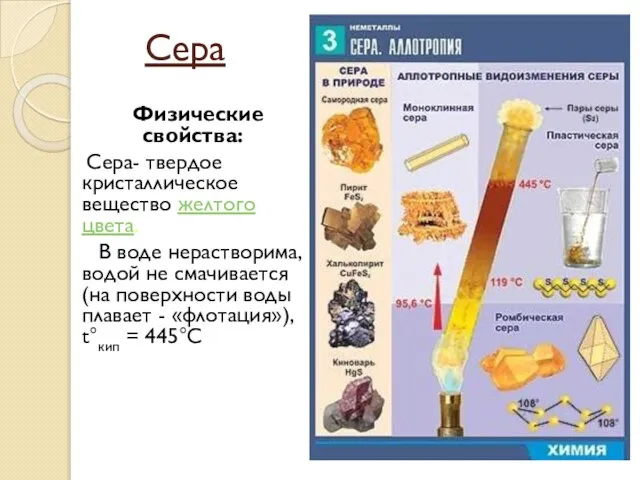
- 9. Сера Физические свойства: Сера- твердое кристаллическое вещество желтого цвета. В воде нерастворима, водой не смачивается (на
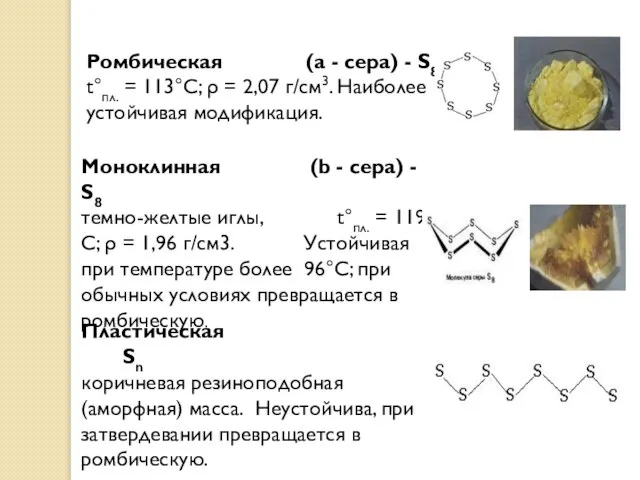
- 10. Ромбическая (a - сера) - S8 t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
- 11. Фосфор Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен
- 12. Биологическая роль соединений фосфора Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит
- 13. Белый, красный, чёрный и металлический фосфор
- 14. Белый фосфор Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему
- 15. Красный фосфор Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. Имеет оттенки
- 16. Чёрный фосфор Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма
- 17. Металлический фосфор При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую
- 18. Свободный углерод В свободном виде углерод встречается в нескольких аллотропных модификациях – алмаз, графит, карбин, крайне
- 19. Алмаз Бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе веществ, но при
- 20. Куллинан (алмаз)- 621,35 грамма, размеры: 100х65х50 мм Бриллианты: Куллинан-1, Куллинан-2, Куллинан-3 и 4
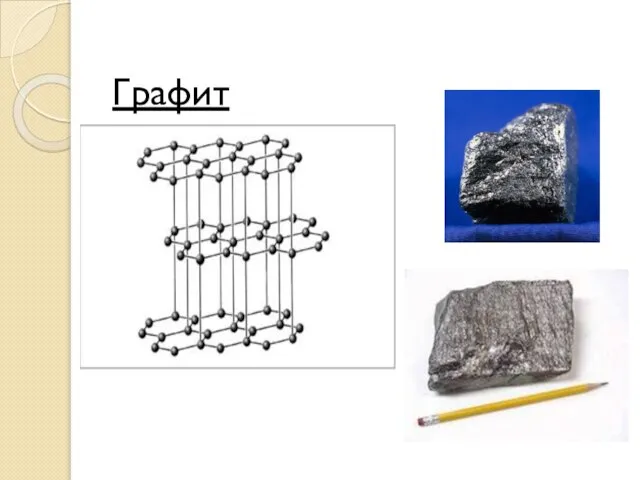
- 21. Графит Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск,
- 22. Графит
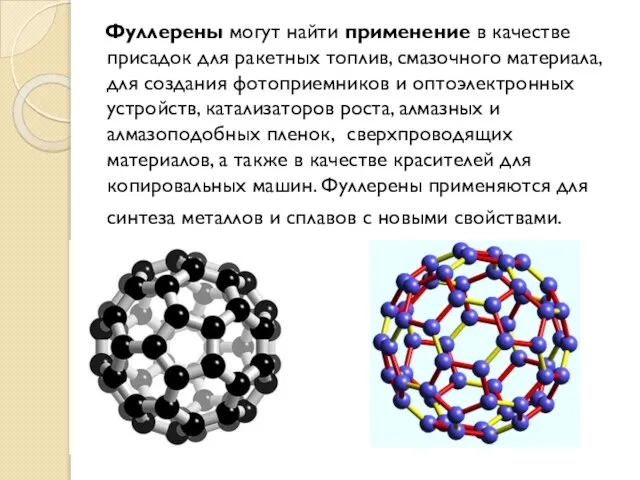
- 23. Фуллерены Фуллерены – класс химических соединений, молекулы которых состоят только из углерода, число атомов которого четно,
- 24. Фуллерены могут найти применение в качестве присадок для ракетных топлив, смазочного материала, для создания фотоприемников и
- 25. Карбин Карбин конденсируется в виде белого углеродного осадка на поверхности при облучении пирографита лазерным пучком света.
- 27. Скачать презентацию




















 Компьютер и здоровье глаз
Компьютер и здоровье глаз Пейзаж.Времена года
Пейзаж.Времена года Организационное и информационное обеспечение фандрейзинга
Организационное и информационное обеспечение фандрейзинга Сложноподчиненное предложение. Повторение и обобщение изученного.
Сложноподчиненное предложение. Повторение и обобщение изученного. История радио и мобильной связи
История радио и мобильной связи А как ты знаешь физику?
А как ты знаешь физику? Презентация на тему Нефтяная промышленность
Презентация на тему Нефтяная промышленность  Изобразительное искусство барокко
Изобразительное искусство барокко Как начать бизнес в интернете?
Как начать бизнес в интернете? Sony Ericsson: Из VGA в HD
Sony Ericsson: Из VGA в HD Символика Краснодарского края
Символика Краснодарского края Для умных женщин Одна супружеская пара поехала в выходные на озеро порыбачить.
Для умных женщин Одна супружеская пара поехала в выходные на озеро порыбачить. Бюджет для граждан по Решению Совета депутатов МО Александровский район от 23.12.2020
Бюджет для граждан по Решению Совета депутатов МО Александровский район от 23.12.2020 Children's behavior and its influence on their future acts
Children's behavior and its influence on their future acts РАНХиГС_очно_27.09.2022_Акцнт, реф, защ, техн ОС
РАНХиГС_очно_27.09.2022_Акцнт, реф, защ, техн ОС Слова-паразиты, или экология речи
Слова-паразиты, или экология речи Иммунная система и канцерогенез
Иммунная система и канцерогенез  Подарки AI Journey. Предложения. Сберклауд
Подарки AI Journey. Предложения. Сберклауд Философские теории неврозов
Философские теории неврозов Реализация и изучение игры «Жизнь» в среде электронных таблиц (MS Ecxel)
Реализация и изучение игры «Жизнь» в среде электронных таблиц (MS Ecxel) Деструктивность учащегося и образовательной среды: точки соприкосновения
Деструктивность учащегося и образовательной среды: точки соприкосновения БАЛАНС-2W: ПОДГОТОВКА СПРАВКИ 2-НДФЛ
БАЛАНС-2W: ПОДГОТОВКА СПРАВКИ 2-НДФЛ Подготовка граждан к военной службе
Подготовка граждан к военной службе Ультразвуковые накладные расходомеры Flexim
Ультразвуковые накладные расходомеры Flexim Презентация для заказных проектов
Презентация для заказных проектов Поступление на государственную службу
Поступление на государственную службу Оценка достижений учащихся в разновозрастной группе
Оценка достижений учащихся в разновозрастной группе Grand Canyon National Park
Grand Canyon National Park